Поведение - титан
Cтраница 1
 |
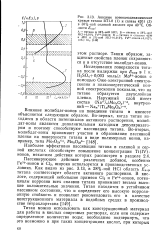
Скорость диффузии кислорода в титане и цирконии. [1] |
Поведение титана на воздухе осложняется влиянием азота. На поверхности металла, помимо TiOj, образуются пленки TiO, ТЛаОэ и, возможно, TIN. Хотя при низких температурах этот процесс протекает медленно, но, начиная с 840 С, его температурное ускорение выше, чем в кислороде, и уже при 1 150 С титан поглощает воздух лучше, чем чистый Оз. [2]
Изучено поведение титана при анодной и катодной поляризации в чистых растворах хлорной кислоты, а также в присутствии соляной и азотной. Выявлены условия активного растворения и пассивирования титана в растворах НСЮ посредством аналитического определения количества титана, перешедшего в раствор. Обсуждаются особенности катодных процессов на титане, с которыми связаны особенности его коррозионного поведения в исследованных средах. [3]
Изучение поведения титана ВТ-1 и более твердого сплава на основе титана ОТ-4 в условиях совместного воздействия НС1 и H2S в растворе показало ( табл. 4.5 и 4.6), что с возрастанием температуры и концентрации соляной кислоты коррозионная стойкость этих материалов падает, причем с увеличением температуры переход от стойкости к нестойкости происходит скачкообразно. Сплав ОТ-4 характеризуется несколько меньшей стойкостью, чем титан ВТ-1. Введение сероводорода в соляную кислоту практически не сказывается на их коррозионной стойкости. [4]
Эта особенность поведения титана и его аналогов обусловлена наличием на их поверхности тонкой пассивирующей пленки оксидов. [5]
Общая картина поведения титана во влажных средах становится более понятной, если рассмотреть электрохимические характеристики систем металл - окисел и окисел - электролит. Термодинамическая устойчивость окислов зависит от разности потенциалов между металлом и раствором, а также от рН раствора. Термодинамическая устойчивость какой-либо нерастворимой фазы еще не означает, что она образует защитную пленку, изолирующую поверхность металла от среды, поскольку это зависит также от физических свойств пленки, которые не могут быть предсказаны на основании термодинамических данных. В области между потенциалом образования сплошной гид-ридной пленки и потенциалом, соответствующим формированию защитной окисной пленки, возникают растворимые ионы титана и происходит быстрая коррозия. [6]
Эта особенность поведения титана и его аналогов обусловлена наличием на их поверхности тонкой пассивирующей пленки оксидов. [7]
Сведения о поведении титана малочисленны. В работах [11, 16] сообщается, что образцы титана испытывались на установках синтеза карбамида и показали удовлетворительную стойкость. Однако место установки образцов не указано. В работе [17] отмечается, что титан обладает пониженной коррозионной стойкостью как в присутствии кислорода в плаве, так и без него. [8]
Сравнение ионного поведении титана ( IV) в кислых средах с коллоидным поведением золей двуокиси титана показывает, что между ними наблюдается аналогия. [9]
Данные о поведении титана в химических средах представлены в табл. 3.9. На практике, однако, независимо от того, какая реакция происходит между металлом и средой, часто приходится учитывать влияние особых условий ( обычно локального характера), способных вызвать коррозию титана даже в неагрессивной среде. К числу факторов, которые необходимо учитывать при выборе конкретного материала для какой-либо конструкции, относятся наличие в ней гальванических пар и глубоких щелей, присутствие в потоке жидкости абразивных частиц, возникновение в материале локальных растягивающих напряжений или приложение пульсирующих сжимающе-растягивающих напряжений. [10]
 |
Анодные потенциодинамические кривые титана ВТ1 - 0 ( 1 и сплава 4201 ( 2 в 30 % - ной соляной кислоте при 40 С. Области. Кор. [11] |
Влияние молибдат-ионов на поведение титана в кислоте объясняется следующим образом. Во-первых, когда титан находится в области потенциалов активного растворения, молиб-дат-ионы являются дополнительным катодным деполяризатором и поэтому способствуют пассивации титана. [12]
Иными словами, поведение титана и циркония в оксалатных растворах является полной противоположностью их поведению в солянокислых растворах. [13]
Результаты лабораторных исследований поведения титана и сталей Х18Н10Т и Х17Н13МЗТ в условиях выделения капролактама из водных растворов представлены в табл. 7.23. Испытания проводились при частой смене раствора, что в какой-то мере приближало их к условиям службы аппаратов. [14]
Наиболее систематические исследования поведения титана в зазорах в концентрированных растворах галогенидов выполнены японскими исследователями [312, 314, 317], которые объясняют возникновение щелевой коррозии следующим образом. Окисная пленка титана обладает высокой стойкостью к действию агрессивных сред, в том числе и к действию ионов хлора. Одчако в воздушно-окисной пленке имеются дефекты. В щелях доступ воды затруднен; кроме того, ионы хлора и других галогенов обладают эффектом высаливания и захватывания имеющейся на поверхности металла воды, поэтому окисная пленка на поверхности титана в щелях не образуется. [15]
Страницы: 1 2 3 4