Поведение - электролит
Cтраница 2
Более ясную картину поведения электролитов при прохождении через них электрического тока дает изменение не удельной, а эквивалентной электропроводности. [16]
Эту аномалию в поведении электролитов объяснил С в а н т е Аррен ус ( 1887 г.), разработавший известную теорию электролитической диссоциации. [17]
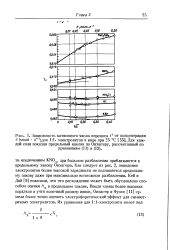
Как следует из рис. 2, поведение электролитов более высокой зарядности не подчиняется предельному закону даже при максимально возможном разбавлении. Кей и Дай [9] показали, что это расхождение может быть обусловлено способом оценки АЭ в предельном законе. Введя члены более высоких порядков и учтя конечный размер ионов, Онзагер и Фуосс [ 11 ] сумели более точно оценить электрофоретический эффект для симметричных электролитов. [19]
Первые достаточно надежные экспериментальные сведения о поведении электролитов при изменении концентрации их водных растворов были получены в лаборатории Фаянса в 20 - х годах нынешнего столетия. Основной результат этих работ состоял в том, что рефракции растворов электролитов изменяются прямо пропорционально изменению концентрации. [20]
Первые достаточно надежные экспериментальные сведения о поведении электролитов при изменении концентрации их водных растворен были получены в лаборатории Фаянса в 20 - х годах нынешнего столетня. Основной результат этих работ состоял в том, что рефракции растворов электролитов изменяются прямо пропорционально изменению концентрации. [21]
Им впервые были выполнены работы по исследованию поведения электролитов в-неводных растворах. [22]
Им впервые были выполнены работы по исследованию поведения электролитов в неводных растворах. [23]
Коэффициент активности можно рассматривать как меру различия поведения электролита в данном растворе и в растворе, который принимается за идеальный. [24]
В этом разделе на основе литературного материала иллюстрируется поведение электролитов в различных растворителях. [25]
Этими особенностями в свободных энергиях сольватации ионов обусловлено поведение электролитов в муравьиной кислоте: сила кислот, особенно слабых, в соответствии с меньшей энергией сольватации протона, ослабляется, а сила солей в соответствии с тем, что суммарная энергия сольватации ионов соли больше, чем в воде ( табл. 39), не ослабляется. [26]
Из сказанного выше ясно, что решение проблемы поведения электролитов сводится к определению коэффициентов активности. [27]
Поведение электролитов в среде нематических жидкокристаллических растворителей отличается от поведения электролитов, растворенных в обычных растворителях. [28]
По теории Аррениуся ГТРПРЦЬ диссоциации является основной ве-личйной, определяющей поведение электролита. [29]
 |
Сопоставление молекулярных констант и степени диссоциации для 0 1 н. раствора галогеноводородов. [30] |
Страницы: 1 2 3 4