Анодное поведение - металл
Cтраница 2
Результаты исследования войдут в создаваемый банк данных по анодному поведению металлов в различных электролитах и будут использованы при создании электрохимического способа переработки полиметаллического сырья. [16]
Полученные результаты показали, что ультразвуковое поле влияет на анодное поведение металлов следующим образом. Прежде всего ультразвуковые колебания облегчают отвод продуктов анодного растворения и тем самым снижают концентрационную поляризацию. [17]
Четвертая глава книги посвящена технически хорошо разработанной области электрохимии - анодному поведению металлов. Ее автор, известный специалист в области коррозии профессор Кембриджского университета Т. П. Хор, вначале уделил большое внимание термодинамической основе проблемы, в связи с чем довольно подробно рассмотрел диаграммы потенциал - рН, значение которых для оценки коррозионных свойств металлов в работах ряда западных школ несколько переоценивается. Несомненно большой интерес представляет вторая часть главы, в которой на основании общих закономерностей электрохимической кинетики рассмотрена кинетика самопроизвольного растворения металлов и их анодное окисление с образованием как растворимых, так и нерастворимых продуктов. В связи с этим рассмотрено также явление пассивности. [18]
Во многих случаях состав технологических растворов настолько сложен [59], что анодное поведение металла на основании исследований в лабораторных условиях поддается лишь весьма приближенной предварительной оценке. [19]
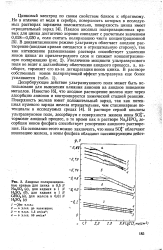 |
Анодные поляризационные кривые для цинка в 0 5. / V Na2SO4 ( а, для кадмия в 1 N H2SO4 ( б, для кадмия в 1 N CdSO4 ( e, для железа в 0 01 N H2S04 ( г. [20] |
Десорбирующее действие ультразвукового поля может быть использовано для выяснения влияния анионов на анодное поведение металлов. Известно [6], что анодное растворение железа идет через адсорбцию анионов и контролируется химической стадией реакции. В растворе серной кислоты ультразвуковое поле, десорбируя с поверхности железа ионы SO -, тормозит анодный процесс, в то время как в растворе Na2HPO4 десорбция ионов фосфата способствует ускорению анодного растворения. [21]
Наряду со сложившимися направлениями современной электрохимии, такими, как теория растворов электролитов и анодное поведение металлов, в книге рассматриваются и сравнительно новые направления, в развитие которых основной вклад сделан в течение последних 10 - 15 лет. Это в первую очередь относится к главам II и V. Как известно, физическая химия ионообменных смол, рассматриваемая во второй главе, начала интенсивно разрабатываться и складываться в самостоятельное научное направление только в послевоенные годы, что связано, в первую очередь, с непрерывно возрастающим использованием ионообменных материалов в технике и развитием их промышленного производства. [22]
Наряду со сложившимися направлениями современной электрохимии, такими, как теория растворов электролитов и анодное поведение металлов, в книге рассматриваются и сравнительно новые направления, в развитие которых основной вклад сделан в течение последних 10 - 15 лет. Это в первую очередь относится к главам II и V. [23]
Для практического исполнения анодной защиты предварительно на лабораторной установке снимают анодные поляризационные потенциостатические кривые, характеризующие анодное поведение металла в данной среде. При высокой электропроводности промышленной среды расположение катодов в аппарате мало влияет на пассивацию поверхности, При низкой электропроводности среды, вследствие возникновения большого градиента потенциала вдоль защищаемой - поверхности, на определенном расстоянии от катода стенки аппарата остаются в активном состоянии и подвергаются коррозии, в то время как вблизи катода потенциал удерживается в области устойчивой пассивности. [24]
На рис. 2.22 показана кривая для никеля в 0 5 М HjSOj [10], иллюстрирующая основные особенности анодного поведения металла, представляющие интерес с точки зрения его коррозионной стойкости. Возможность пассивации не предсказывается равновесной диаграммой потенциал - рН, однако именно пассивация является одной из причин того, что на практике коррозионная стойкость никеля в кислых растворах оказывается лучше, чем это следует из рассмотрения условий термодинамического равновесия. Вторая и, возможно, более важная причина связана с тем, что активная область ( ЛВС) при анодной поляризации никеля значительно больше, чем при анодной поляризации многих других металлов. Этот факт, а также то, что в электрохимическом ряду никель лишь слегка отрицателен по отношению к равновесию Н / Н2, означает, что на практике скорость растворения никеля в кислых растворах будет небольшой в отсутствие более сильных окислителей, чем Н, или веществ, способных ускорять кинетику анодной реакции. [26]
Во второй книге рассмотрены следующие проблемы: современное состояние теории электролитических растворов, физическая химия ионообменных смол, теория расплавленных электролитов, анодное поведение металлов, электрохимия полупроводников. [27]
Однако отмечается [55], что причина, вызывающая смещение потенциала в положительную область, не имеет значения для самого процесса пассивирования: анодное поведение металла, переход его в пассивное состояние и перепассивация зависят только от величины потенциала, но не от причины, обусловливающей его поддержание. Этот экспериментальный факт указывает на то, что кислород, необходимый для пассивирования, поставляется не окислителем ( по крайней мере для первичных актов пассивирования), а водой. При достаточно высоком анодном потенциале металл взаимодействует с молекулами воды или ионами ОН -, что приводит к пассивации. В связи с тем, что в пассивном состоянии металлы корродируют, с невысокими скоростями, представляло интерес сравнить коррозию различных металлов, существенно отличающихся своими физико-химическими свойствами, а следовательно, и склонностью к пассивированию в окислительных средах. В ней наряду со скоростями коррозии приведены некоторые физические константы ( теплота сублимации, температура плавления), характеризующие силу межатомной связи в кристаллической решетке. Попытка сопоставления таких констант со скоростями коррозии вызвана желанием установить хотя бы качественную взаимосвязь между скоростью анодного процесса ( скоростью коррозии), пассивностью и физическими константами, указывающими на силу межатомной связи. [28]
Вопрос о защитном интервале потенциалов, который может быть использован при практическом осуществлении анодной защиты, во всех случаях должен решаться на основании лабораторных исследований анодного поведения металла йли сплава в данной среде. В настоящее время, количество работ, содержащих результаты таких исследований для различных металлов и сплавов в различных средах, весьма велико и оно непрерывно возрастает. [29]
Указанные работы, безусловно, имеют большое значение для предварительной оценки возможности применения анодной защиты, допустимости замены высоколегированной стали на менее легированную, определения возможного уменьшения содержания легирующих элементов при применении анодной защиты. Зная анодное поведение металлов в растворах различного анионного состава, можно предварительно оценить влияние примесей тех или иных веществ на коррозионную стойкость металла в технологических растворах. [30]
Страницы: 1 2 3
