Поверхность - металлический катализатор
Cтраница 3
Прежде чем перейти к рассмотрению этой большой группы исследований, целесообразно остановиться на одном вопросе, имеющем общее значение. Во всех этих работах принимается представление о существовании на поверхности металлических катализаторов, при протекании подобных реакций, адсорбированных атомов водорода, обладающих повышенной химической активностью. Выводы о свойствах поверхностного водорода и, в частности, об его активности делаются, однако, только на основании анализа самих кинетических данных, для объяснения которых и предполагается его существование. [31]
Нет возможности перечислить все реакции, которые; могли протекать под влиянием этих катализаторов на берегах и отмелях первичного океана и при совместном действии света и катализаторов, однако полезно обратить внимание на возможность каталитических эффектов, мало изученных в лабораторных условиях, но несомненно способных сыграть существенную роль в первичных процессах синтеза. К таким эффектам относится, в частности, адсорбционное промотирование, вызываемое адсорбцией органических молекул на поверхности полупроводниковых и металлических катализаторов. [32]
Тем не менее некоторые, главным образом фосфор - и серусодержащие вещества, обладают, как указывалось выше, способностью стабилизировать также и моторные масла, особенно при окислении в тонком слое на металле. Как показано Б. В. Лосико-вым, антиокислительное действие в этом случае связано со способностью серу - и фосфорсодержащих присадок пассивировать поверхность металлических катализаторов, ускоряющих в отсутствии присадок окисление масла. [33]
Кинетика каталитических реакций иногда отличается от кинетики соответствующих некаталитических реакций. Так, разложение йодистого водорода ( которое, как известно, происходит по кинетическому уравнению второго порядка) на поверхности металлических катализаторов становится реакцией первого порядка. В органической химии известны многочисленные случаи, когда разные катализаторы вызывают различные реакции одних и тех же веществ. [34]
С помощью этих методов экспериментально доказано существование поверхностных химических соединений. Так, при каталитической гидрогенизации и дегидрогенизации образуется полугидрированная форма [1], которая в случае гидрирования этилена представляет собой радикал этил, прикрепленный к поверхности металлического катализатора. Поверхностный алкоголят представляет собой нестойкое химическое поверхностное соединение, разлагающееся ( как в случае адсорбционных, так и кинетических измерений) до эфира или этилена и воды. [35]
Химические реакции протекают как между различными молекулами, хемосорбированными соседними центрами катализатора, так и между хемо-сорбированными молекулами одного из реагентов и молекулами второго реагента, поступающими из газовой фазы. Силы, принимающие участие в хемосорбции, настолько значительны, что вызывают разрыв таких молекул, как Н2 на свободные атомы, которые остаются связанными с поверхностью металлических катализаторов. [36]
Переходя к рассмотрению металлов, я хочу прежде всего отметить значительные успехи в методах исследования, позволяющие изучать структуру и адсорбционные свойства очень чистых поверхностей металлов. Трудно переоценить значение свойств чистых поверхностей металлов, но, используя их в области катализа, необходимо помнить, что они могут очень сильно отличаться от свойств поверхности металлических катализаторов в стационарном состоянии при протекании каталитических реакций. Таким образом, накопление информации о хемосорбционных свойствах металлов идет по двум расходящимся направлениям, и очень важно найти правильные пути их одновременного использования. [37]
Отсюда можно сделать вывод, что кристаллографическая ориентация грани влияет на ее каталитическую активность. Эти данные согласуются с результатами, полученными Биком и Ричи [93], которые показали, что неориентированные металлические пленки отличаются по своей каталитической активности от ориентированных пленок. Таким образом, во многих случаях неоднородность поверхности очень чистых металлических катализаторов может быть обусловлена тем, что на этих поверхностях представлены в большом количестве различные кристаллические грани. [38]
Роль носителя в этой реакции значительно возрастает, особенно в области разведенных слоев. Указанная реакция по своей схеме имеет много общего с реакцией восстановления я-бенэохинона и нитросоединений. В обоих случаях кислородсодержащие соединения - акцепторы электронов адсорбируются на поверхности металлического катализатора, отнимая от него ( электроны, с образованием отрицательно заряженных соединений. Восстановитель - донор электронов ( водород, окись углерода) активируется на поверхности при мгновенной адсорбции из газовой фазы с отдачей электрона. [40]
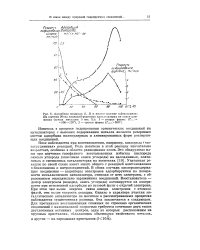
Изотермы адсорбции для этих трех адсорбентов показаны на рис. 7, где по одной оси отложены логарифмы количества адсорбированного газа, а по другой оси - логарифмы равновесных давлений. Частичная диссоциация на феррите меди представляет собой, повидимому, разложение молекулы на окись углерода и атом кислорода по схеме СОа СО - - О. Аналогичным способом было показано, что водород [15, 16], так же как и азот [27], диссоциирует на атомы на поверхности металлических катализаторов. [41]
В разделе IV было показано, что поверхность восстановленного металлического катализатора, так же как и поверхность окис-ного катализатора, можно считать однородной или, по крайней мере, частично однородной. Ребра кристаллитов и трещины, которые, как иногда полагали, являются активными центрами при катализе, по мнению автора, лишь в незначительной степени влияют на активность. Поэтому исследование адсорбции и катализа на монокристаллах какого-либо определенного металла может иметь, повидимому, большое значение для понимания свойств и природы поверхности обычных металлических катализаторов. [42]
Вносилась также поправка на изменения скорости процесса от температуры и на отклонения трансмиссионного коэффициента от единицы, но это никак не устраняет эмпирический характер расчетов. В последней работе [182] для расчетов числа оборотов разных реакций в основном используются L, близкие к Ю15 см-2. Поэтому такие расчеты, фактически использующие представления теории абсолютных скоростей реакций ( хотя и формально), без детального выяснения механизма процессов и всестороннего анализа кинетических закономерностей вряд ли могут служить источником информации о количестве активных мест поверхностей металлических катализаторов. [43]
Именно поэтому она и рассматривается в этом разделе, а не среди радикальных реакций. Прямое присоединение водорода обычно проводят в условиях гетерогенного катализа тонкоизмельченными металлами, такими как Ni, Pt, Pd, Ru, Rh. Атомы металла, расположенные на поверхности кристалла, в отличие от атомов внутри кристалла, имеют нескомпенсированные валентности, направленные в стороны от поверхности. В результате этого как алкены ( например, этен), так и водород реагируют с поверхностью металлического катализатора, например никеля, экзотермически и обратимо. Взаимодействие алкенов с металлом осуществляется с помощью я-электронов, тогда как алканы не могут адсорбироваться подобным образом. [44]
Ямагути [86] позднее исследовал граничные поверхности этих образцов как методом диффракции электронов, так и при помощи электронного микроскопа, применяя способ оксидных реплик. Однако пока еще не известен такой метод испытания, который позволил бы установить, что атомы на полированных поверхностях этих монокристаллов находятся в идеально упорядоченном состоянии. ПО) более чувствительна к окислению. Большое значение имеют исследования Бэнтона и Гватми [87], Ледхайзера и Гватми [88, 89], а также Родина [90] ( см. стр. Эти авторы получили приблизительно плоские по форме монокристаллы и определили адсорбционные характеристики и каталитическую активность этих образцов. Было показано, что у монокристалла меди плоскость ( 100) более легко окисляется кислородом по сравнению с другими плоскостями. Это убедительно доказывает, что на поверхности металлических катализаторов селективно отравляются определенные кристаллические грани. [45]
Страницы: 1 2 3