Поверхность - корродирующий металл
Cтраница 2
Теоретически доказано, что поверхность корродирующего металла остается приблизительно эквипотенциальной и при наличии неоднородностей, если только размеры включений малы, а электропроводность электролита достаточно велика. [16]
Если в данном месте поверхности корродирующего металла анодные и катодные плотности тока постоянны, имеет место однородный ( гомогенный) смешанный электрод, для которого характерен равномерный унос вещества с поверхности. [17]
Вещества, способные создавать на поверхности корродирующего металла защитные оксидные пленки с участием его ионов. Следует различить прямое окисление поверхности металла добавкой, что, по-видимому, наблюдается крайне редко, и торможение анодной реакции со смещением потенциала до значения, при котором возможны разряд молекул воды или ионов гидроксида и адсорбция на металле образующихся атомов кислорода. Количество кислорода на поверхности возрастает и создает сплошной моноатомный слой, который практически не отличим от поверхностного оксида. Оксид может образовываться и в результате окисления добавкой ионов металла, уже перешедших в раствор, до ионов более высокой валентности ( например Fe до Fein), способных образовывать с гидроксильными ионами менее растворимую защитную пленку. [18]
Одной из распространенных причин дифференциации поверхности корродирующего металла на катодные и анодные участки являются различия в составе электролита. Очень часто эти различия вызываются неравномерным распределением катодного деполяризатора, как, например, при образовании коррозионных пар дифференциальной аэрации за счет затрудненного доступа кислорода к отдельным участкам поверхности металла. Будучи анодными по отношению ко всей остальной поверхности, эти участки становятся очагами локализованного коррозионного разрушения. [19]
Одной из распространенных причин дифференциации поверхности корродирующего металла на катодные и анодные участки являются различия в составе электролита. Очень часто эти различия вызываются неравномерным распределением катодного деполяризатора, как, например, при образовании коррозионных пар дифференциальной аэрации за счет затрудненного доступа кислорода к отдельным участкам поверхности металла. Будучи анодным по отношению ко всей остальной поверхности, эти участки становятся очагами локализованного коррозионного разрушения. [20]
 |
Схема пятиэлектрод - Электролит При ЭЛеКТрОХИМИЧССКОЙ. [21] |
Таким образом, электрохимическая гетерогенность поверхности корродирующего металла приводит к дифференциации последней на анодные ( с более отрицательным электродным потенциалом Va) и катодные ( с более положительным электродным потенциалом Ук) участки. [22]
В зависимости от степени увлажнения поверхности корродирующих металлов различают сухую и влажную атмосферную коррозию. При сухой атмосферной коррозии разрушение металла идет по чисто химическому механизму, когда агрессивные агенты ( например, кислород воздуха, сероводород и др.) взаимодействуют с поверхностью металла. Влажная атмосферная коррозия представляет собой особый случай электрохимической коррозии, когда коррозионные процессы идут под пленкой влаги, выполняющей роль электролита. [23]
С увеличением площади катодных участков на поверхности корродирующего металла возрастает ток коррозии и снижается перенапряжение водорода, поэтому скорость коррозии металла будет увеличиваться до тех пор, пока на корродирующей поверхности металла не возникнет плотный слой вторичных продуктов коррозии, препятствующий соприкосновению металла со средой. [24]
С увеличением площади катодных участков на поверхности корродирующего металла снижается перенапряжение водорода, что приводит к росту коррозионного тока, поэтому скорость коррозии металла будет повышаться. [25]
Эти нерастворимые соединения, осаждаясь на поверхности корродирующего металла или неровностях покрытия, создают барьер, который частично изолирует металл от окружающей среды. [26]
Как уже указывалось ранее, гидрофилизация поверхности корродирующего металла и появление на нем тонкого слоя электролита тесно связаны с явлением избирательного смачивания на границе твердого тела и двух несмешивающихся жидкостей. Учет этого обстоятельства имеет важное значение в рассматриваемом случае. [27]
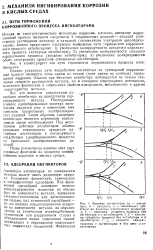
Если принять, что распределение ингибитора по поверхности корродирующего металла отвечает принятой модели ( рис. 5), то можно полагать, что на разных участках поверхности скорость коррозии будет существенно отличаться. Энергетический барьер на той части поверхности, на которой находятся изолированные частицы ингибитора, постоянно меняющие места своего расположения ( в результате поверхностной диффузии и обмена с окружающей средой), создается благодаря адсорбционному потенциалу. [28]
Все это является результатом адсорбции ингибитора на поверхности корродирующего металла. Последующее влияние адсорбированных молекул ингибитора сводится уже к изменению ими кинетики парциальных электрохимических реакций. Таким образом, адсорбция ингибитора является первичным необходимым актом ингнбирования. Под механизмом действия ингибиторов обычно понимают совокупность процессов ад - -) сорбции ингибиторов и последующего воздействия адсорбированного вещества на протекание электрохимических реакций. [30]
Страницы: 1 2 3 4