Поверхность - белок
Cтраница 2
Они отражают влияние сольватации неполярных участков в дополнение к гидратации других частей поверхности белка и поэтому могут рассматриваться как наиболее совершенная термодинамическая характеристика взаимодействий вода - белок. Теплоемкость удобно измерять как в растворе, так и в твердых образцах, поэтому можно сопоставить результаты исследования теплоемкости этих двух групп образцов. По темплоемкости малых молекул имеется достаточно обширная литература, и для нее более, чем для других термодинамических функций, применимы соотношения аддитивности. Измерения темплоемкости белков выполняются с помощью дифференциальных сканирующих калориметров, которые позволяют получить теплоемкость как функцию температуры, и реже - с помощью капельных калориметров, которые дают значение теплоемкости при фиксированной средней температуре. Например, из измерений на коллагене [11] следует, что для образцов со степенью гидратации 0 35 г воды / г белка не наблюдается никакого перехода. Отсюда можно сделать вывод, что по крайней мере данное количество воды взаимодействует с белком настолько сильно, что она не может замерзнуть. [16]
Желание понять структурные, функциональные и динамические факторы, характеризующие поведение воды на поверхности белка и других поверхностях, а также их взаимосвязи стимулирует интерес исследователей к этой проблеме. Спектроскопия ядерного магнитного резонанса позволяет получить информацию как о структуре, так и о динамике процессов взаимодействия. В настоящей работе внимание сосредоточено на динамических аспектах взаимодействия воды с белком. Особенно подробно обсуждено явление перекрестной релаксации между протонами воды и белка и приведены новые доказательства существования этого процесса. Непонимание значения перекрестной релаксации приводит к неправильным заключениям относительно динамики воды на белковых поверхностях. [17]
Из приведенных структурных формул видно, что избирательность взаимодействия детергента с гидрофобным участком на поверхности белка может быть обусловлена структурным соответствием этого участка ( имеются в виду размеры, конфигурация, преобладание алифатических или ароматических остатков аминокислот) и гидрофобной части детергента. [18]
По данным рентгеноструктурного анализа, железопорфирины в гемоглобинах и миоглобинах локализуются в неполярных карманах вблизи поверхности белка, причем между атомами порфирина и белка имеется около 60 точек контакта, в которых атомы белка и простетической группы удалены друг от друга менее чем на 400 пм. Эти контакты включают координационную связь между железом и гистидином F8 и водородные связи карбоксильных групп одной или обеих групп пропионовых кислот в положениях 6 и 7 порфирина. Исследования влияния вариаций боковых групп порфирина, удаления металла и замены различных аминокислот в белке ( в мутан-тных гемоглобинах) указывают на большую роль этих типов взаимодействия. [19]
На примере ионизации цистеина, выбранного в качестве простой модели, можно проиллюстрировать, что диссоциация на поверхности белка отражает сложное взаимодействие мономерных остатков аминокислот. [20]
Для понимания природы ферментативного катализа и других свойств белков необходимо описать движение воды и других молекул на поверхности белка. [21]
При извлечении масла из мятки, мезги и жмыхов происходит последовательное освобождение ( отделение) адсорбированных липидных веществ с поверхности белка. Вначале извлекаются наименее связанные глицериды и последними - жирные кислоты, поэтому в последней стадии отжима масла на прессах или при экстракции концентрация свободных жирных кислот в масле повышается. [22]
Установлено, что на поверхности антитела имеются чаще всего две чрезвычайно специфические группы - активные центры, жадно соединяющиеся с некоторыми группами на поверхности антигенных белков. Антигеном может служить почти каждый белок организма чуждого вида. Антигенами служат белки, составляющие поверхностную оболочку бактерий или вирусов. В последнее время показано, что антигеном может явиться ДНК, подвергнутая тепловой денатурации 200 некоторые синтетические полипептиды, содержащие основные аминокислоты, в особенности гистидин. Однако в последних случаях нет уверенности, что ДНК или полипептид не соединяются предварительно с одним из белков крови животного, подвергнутого иммунизации, и уже в таком виде становятся антигенами. [23]
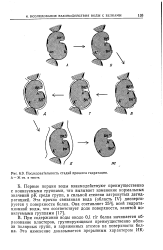 |
Последовательность стадий процесса гидратации. А - Ж в тексте. [24] |
При содержании воды около 0 1 г / г белка начинается образование кластеров, группирующихся преимущественно вблизи полярных групп, и заряженных атомов на поверхности белка. [25]
При использовании белков в качестве лигандов о выборе точки закрепления в большинстве случаев не может идти речи - таких точек, как правило, на поверхности белка много. К счастью, биологическая, и в частности ферментативная, активность белка нередко сохраняется при фиксации его в разных точках, если при этом активный центр белковой макромолекулы остается экспонированным. Разумеется, для некоторой доли молекул фермента точка связывания может оказаться в активном центре или вблизи него, что помешает взаимодействию с ним субстрата. Этим, в частности, обусловлено снижение суммарной активности при закреплении ферментов на матрицах. [26]
Учет дальних взаимодействий основан на том, что значительное число гидрофобных групп должно быть погружено в гидрофобное ядро, а гидрофильные группы должны преимущественно находиться на поверхности белка. При оценке склонности определенного участка полипептидной цепи к формированию - спирали проверялась возможность образования им гидрофобного кластера, который в геометрии - спирали определялся как поверхность, вырезаемая центральным двухгранным углом - 120 вдоль которой группируется максимальное число гидрофобных остатков. [27]
Некоторые белки, разумеется, содержат внутреннюю воду, и такие молекулы воды, без сомнения, имеют значительно большую продолжительность пребывания на одном месте, чем молекулы вне поверхности белка. Эти молекулы являются важной частью белка, связывая водородными связями области, которые иначе имели бы ненасыщенные связи. Серин-протеазы - химотрипсин [29], трипсин [30] и эластаза [31] - имеют значительное число внутренних молекул воды: 24 - 25 для трипсина и эластазы и находятся в основном в соответствующих местах этих подобных друг другу структур. [28]
Таким образом, спектральные свойства Со ( П) - замещенного фермента в видимой области указывают на то, что молекулы упорядоченной структуры растворителя в области активного центра находятся в зависящем от рН равновесии с неупорядоченными молекулами растворителя на поверхности белка. С точки зрения структуры природа изменений боковых цепей аминокислот в области активного центра при изменении рН, ответственных за образование упорядоченной структуры растворителя, не ясна. Однако это не означает, что при низких значениях рН молекулы растворителя не координированы с ионом металла. [29]
Из приведенного обсуждения ясно, что рентгенографические данные вместе с большим количеством данных гидродинамических измерений свидетельствуют, что молекулы белка в водном растворе окружены одним ( или около того) слоем молекул гидратационной воды, находящихся в строго определенных местах поверхности белка. [30]
Страницы: 1 2 3 4