Поверхность - белок
Cтраница 3
Поверхность белка в целом гидрофильная, весьма разнообразна по природе, в результате чего на ней более или менее прочно связываются все типы лигандов, от маленьких противоионов до других макромолекул. В любой момент времени несколько таких лигандов могут присоединяться или удаляться с поверхности; время их пребывания на поверхности зависит от силы связывающих взаимодействий. [31]
Конденсация воды над наиболее слабо взаимодействующими участками поверхности ( неполярными областями) приводит к образованию многослойного покрытия при степени гидратации 0 4 г воды / г белка. На поверхности белка вода должна располагаться особым локальным образом для достижения высокого значения степени покрытия в расчете на одну молекулу адсорбированной воды. Конденсация является главным этапом процесса гидратации. Подвижность системы белок - вода резко увеличивается после завершения формирования монослоя. [32]
Исключение составляют мембранные белки, контак-тирующие с неполярной жирной внутр. На поверхности белка в этом случае находятся гидрофобные аминокислотные остатки. [33]
Электрофорезом называют физический процесс разделения заряженных частиц в электрическом поле постоянного тока. Заряды на поверхности белков возникают вследствие ионизации карбоксильных, амино -, имидазольных, фенокси - и сульфгид-рильных групп, а также при связывании ионов. [34]
Уменьшение внешней поверхности белковых комплексов под влиянием денатурации приводит к сокращению связей взаимодействующих с молекулами глицеридов. По этой причине масло на денатурированной поверхности белка располагается в виде полимолекулярных слоев. [35]
Вероятности мутаций для различных остатков приведены в табл. 9.2. Значения, находящиеся на диагонали, представляют вероятность того, что данный остаток будет сохраняться. Ser, который часто находится на поверхности белка, имеет наименьший диагональный член, что означает наибольшую вероятность мутации. Наименьшая вероятность мутации соответствует Тгр. Это вполне объяснимо, поскольку Тгр обычно является внутренним остатком и его трудно заместить остатком с боковой цепью равной величины. [36]
Действительно, неупорядоченные части белковых цепей обладают такой способностью. Под влиянием субстрата происходит конформационное превращение на поверхности белка, происходят повороты звеньев цепи, ротамеризация. В этом смысле ферментативная активность объясняется идеями ротамерной физики, так же как и упругость каучука. Это не случайно: и каучук и белок - полимеры, а ротамеризация есть общее свойство полимерных молекул. [37]
Действительно, неупорядоченные части белковых цепей обладают такой способностью. Под влиянием субстрата происходит конформационное превращение на поверхности белка, происходят повороты звеньев цепи, ротамеризация. В этом смысле ферментативная активность объясняется идеями ротамерной физики, так же как и упругость каучука. Это не случайно: и каучук и белок - полимеры, а ротамеризация есть общее свойство полимерных молекул. [38]
Предыдущее описание взаимодействий белок - растворитель с помощью энергетической карты пространства растворителя вблизи молекулы белка является лишь первым, грубым приближением к полному решению проблемы. Так как форма и главные особенности пространства растворителя вблизи поверхности белка на этих картах ясно обозначены, то легко видеть, что включение в вычисления сильных и строго направленных взаимодействий между молекулами воды приведет к тому, что пространство, занятое растворителем, будет охарактеризовано различным образом, особенно в отношении структуры гидратных оболочек за его пределами. Вследствие того что большая часть растворителя находится в разупо-рядоченном состоянии, необходимо статистическое описание, а именно следует рассмотреть большое число различных конфигураций системы белка и растворителя, каждая из которых дает свой вклад в усредненные свойства системы пропорционально значению больцмановского фактора. [39]
Подобные эффекты обнаружены как на сложных белках, состоящих из нескольких субъединиц, так и на простейших белках, состоящих всего из одной субъединицы. При этом оказалось, что эти перестройки затрагивают не всю поверхность белка, а лишь ее определенные участки. Последнее существенно не только для выяснения природы трансглобулярных эффектов, но и служит доказательством того, что в этих системах за регистрируемые изменения спектров действительно ответственны перестройки локального окружения спиновых меток, а не просто изменение частот вращения самой молекулы белка. [40]
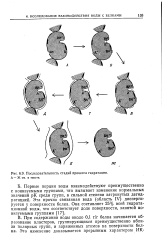 |
Последовательность стадий процесса гидратации. А - Ж в тексте. [41] |
Первые порции воды взаимодействуют преимущественно с ионизуемыми группами, что вызывает изменение нормальных значений рК среди групп, в сильной степени затронутых дегидратацией. Эта прочно связанная вода ( область IV) диспергируется у поверхности белка. [42]
Автор обратил внимание на то, что повороты располагаются почти исключительно на поверхности белка. В связи с этим он высказал предположение, что все триплеты полярных остатков ( обозначенные буквой Т в табл. 6.2) имеют конформацию реверсивного поворота. [43]
Из приведенного примера следует, что удельная маслоемкость белковых веществ в результате технологической обработки их становится выше, чем удельная маслоемкость исходного материала. С увеличением степени от-жатия масла из белковой части содержание жирных кислот на поверхности белка увеличивается, а содержание глицеридов уменьшается. [44]
Ограниченность наших представлений о механизме сорбции кислых белков на оксиапатите с еще большим основанием следует отнести к механизму сорбции основных белков. Вероятно, в ней участвуют кулоновские взаимодействия положительно заряженных остатков аминокислот на поверхности белка с отрицательно заряженными остатками фосфорной кислоты, которые тоже должны быть на поверхности оксиапатита. Об этом говорит более прочная сорбция полилизина и полиаргинина, чем других, более нейтральных полипептидов. Но вполне возможно, что и иные виды взаимодействия здесь играют важную роль. [45]
Страницы: 1 2 3 4