Поверхность - окись - алюминий
Cтраница 1
Поверхность окиси алюминия ионизуется, так как она покрыта в какой-то степени протонами, соединенными или с атомами кислорода в решетке окиси алюминия, или с ионами фтора, химически адсорбированными поверхностью окиси алюминия. [1]
Поверхность окиси алюминия, как и кремнезема, покрыта структурными гидроксильными группами. [2]
На поверхности окиси алюминия были идентифицированы гидроксильные группы трех типов, и оказалось, что связи групп ОН с поверхностью АЦОз носят преимущественно ионный характер. Гидроксильные группы легко обменивают водород, но скорость обмена значительно ниже, чем при изомеризации бутена-1 на том же катализаторе. [3]
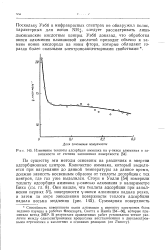 |
Изменение теплоты адсорбции аммиака на у-окиси алюминия в зависимости от степени заполнения поверхности. [4] |
Способность поверхности окиси алюминия к переносу электронов была недавно изучена в работах Флокхарта, Скотта и Пинка [64-66], которые применяли метод ЭПР. [5]
 |
Дегидратация поверхности окиси алюминия, покрытой гидроксильными группами. [6] |
Природа поверхности окиси алюминия важна при ее применении в качестве адсорбента в хроматографии. Этот вопрос освещен в специальной литературе. Анионы адсорбируются вместе с двухвалентными катионами, но не с одновалентными [ 346а ], что снова указывает на эквимолекулярный ионный обмен. [7]
Активность поверхности окиси алюминия растет по мере увеличения температуры обработки образца и достигает своего максимального значения при 900 С для образца, в котором вся у - АЬОз превратилась в корунд. Однако, если относить величины теплот не к 1 м2 поверхности, а к 1 г образца, благодаря резкому падению удельной поверхности при высоких температурах ( рис. 1), максимальное значение теплот получается для образца, прокаленного при 500 С. Исследование вторично гидратироваиных образцов, как это следует из рис. 2 и 3, показало, что степень гидратации поверхности и теплота смачивания ( водой), в отличие от оиликагеля [3], оказались даже несколько большими, чем для исходного образца, обработанного при тех же условиях. Вторичная гидратация поверхности проводилась путем выдерживания образцов в жидкой воде не менее семи суток с последующей сушкой при 200 С в течение 24 часов. [8]
Изучение свойств поверхности окиси алюминия встречает большие трудности, чем исследование поверхности чистых кремнеземов. Окись алюминия в отличие от чистых кремнеземов обладает каталитическими свойствами вследствие наличия на ее поверхности активных центров, вызывающих сложные превращения многих адсорбированных на ее поверхности молекул. [9]
При адсорбции на поверхности окиси алюминия эти молекулы принимают окраску, сходную с окраской продуктов их ионизации в растворах сильных кислот. Эти результаты были приписаны ионизации неполярных соединений под влиянием полярной поверхности. Если предположить, что эта интерпретация правильна, то наблюдения, приводимые выше, являются первой качественной демонстрацией образования ионов карбония на поверхности активированной окиси алюминия, которую можно принять за доказательство кислотной природы поверхности препарата активированной окиси алюминия. Хотя ионизация и может иметь место в некоторых случаях изменения окраски, из результатов де Бура с очевидностью следует, что выводы, основанные исключительно на визуальных наблюдениях, должны делаться с оговоркой. [10]
Таким образом, на поверхности окиси алюминия часть платины, связанная с окисью алюминия и хлором, обладает специфической активностью в реакции образования цикла, но не катализирует реакции дегидрирования циклогексана. [11]
Синтез двуокиси титана на поверхности окиси алюминия основан на двух последовательных реакциях: взаимодействие паров четыреххлористого титана с предварительно гидроксилированной поверхностью алюминия и последующий гидролиз хлор-фупп парами воды, что приводит к возобновлению гидроксильных фупп. [12]
При адсорбции ацетилена на поверхности окиси алюминия Иейтс и Луккези ( 1961) нашли полосу поглощения валентного колебания углерод - углерод, обычно запрещенную в инфракрасном спектре. Частоты этих полос могут быть сопоставлены с полосами поглощения при 1974 и 1961 см 1, наблюдавшимися в спектре комбинационного рассеяния для газообразного и жидкого ацетилена соответственно. [13]
Метод нанесения металла на поверхность окиси алюминия иг -, рает существенную роль. Для никелевых катализаторов, полученных методом совместного осаждения, удельная поверхность катализаторов, содержащих до 50 % никеля, остается постоянной и равной поверхности исходного носителя и только дальнейшее увеличение количества никеля приводит к уменьшению удельной поверхности катализатора. [14]
Окись хрома, нанесенная на поверхность окиси алюминия, является активным катализатором многих химических реакций, как, например, ароматизации, дегидрирования и полимеризации. Эти авторы нашли, что магнитный момент для всех концентраций Сг2О3 приблизительно постоянен и соответствует трем неспаренным электронам; константа Вейсса, напротив, изменяется от нуля при низких концентрациях ( - 1 вес. [15]
Страницы: 1 2 3 4