Поверхность - окись - алюминий
Cтраница 2
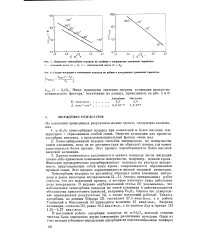 |
Первичная хемосорбция водорода на сапфире в координатах уравнения Лррениуса. [16] |
Хемосорбированный водород способен мигрировать по поверхности окиси алюминия, пока он не достигнет ( или не образует) центра, где может удерживаться более прочно. Этот процесс характеризуется более высокой энергией активации. [17]
Окись хрома, нанесенная на поверхность окиси алюминия, является активным катализатором многих химических реакций, как, например, ароматизации, дегидрирования и полимеризации. Эти авторы нашли, что магнитный момент для всех концентраций Сг2О3 приблизительно постоянен и соответствует трем неспаренным электронам; константа Вейсса, напротив, изменяется от нуля при низких концентрациях ( - 1 вес. [18]
Каталитические исследования показывают, что поверхность окиси алюминия более активна к химическому взаимодействию с электронодонорными молекулами, чем поверхность кремнезема. Поскольку свойства структурных гидроксильных групп поверхности окиси алюминия в отношении взаимодействия с адсорбированными молекулами существенно не отличаются от свойств гидроксильных групп кремнезема, то такое различие в химической активности может быть следствием существования на поверхности других, более активных центров адсорбции. [19]
При адсорбции молекул воды на поверхности окиси алюминия, хемосорбировавшей предварительно аммиак, наблюдался рост интенсивности полос поглощения иона аммония. Дункен и Финк [15, 16] подчеркивают, что этот процесс нельзя рассматривать с точки зрения упрощенной схемы превращения апротонного центра в протонный. [20]
Когда уровень растворителя подойдет к поверхности окиси алюминия, в колонку наливают 2 - 3 мл экстракта каротиноидов из перца ( или 5 - 6 мл из моркови или шиповника), не меняя скорости отсасывания. [21]
АЬОз значительно легче, чем с поверхности окиси алюминия. Продукты десорбции, образующиеся в результате обработки водородом при сравнительно низких температурах [ 100 - 150 С ], состоят, в основном, из метана и бутана, но при повышении температуры, когда возможен разрыв связи С-С, возрастает количество метана и пропана. Большая легкость удаления адсорбированных соединений с поверхности катализатора Р1 / А12Оз по сравнению с чистой АЬОз позволяет предположить, что здесь существенную роль может играть миграция поверхностных соединений между металлом и носителем. [22]
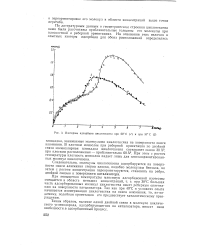 |
Изотермы адсорбции циклогексена при 20 С ( 1 и при 30 С ( 2. [23] |
Следовательно, молекулы циклогексена адсорбируются на поверхности окиси алюминия сперва плоско, подобно молекулам бензола, но затем с ростом концентрации переориентируются, становясь на ребро, двойной связью к поверхности катализатора. [24]
Что касается природы кислотных центров на поверхности дегидратированной окиси алюминия, то химические данные свидетельствуют, скорее, в пользу льюисовских центров, нежели брен-стедовских. Трамбуз и Перрин [ 3431 определили содержание льюисовских центров термометрическим титрованием суспензии в бензоле диоксаном. Они установили, что льюисовская кислотность на наблюдается в бемите и продуктах его дегидратации, а появляется только в веществах, полученных из гидраргилита. [25]
Было найдено, что апротонные центры поверхности окиси алюминия проявляют наибольшую электроотрицательность. [26]
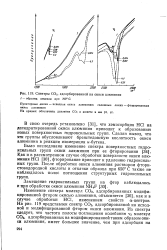 |
Спектры СО2, адсорбированной на окиси алюминия / - образец откачан при 700 С. [27] |
Как и в рассмотренном случае обработки поверхности окиси алюминия НС1 [30], фторирование приводит к удалению гидроксильных групп. [28]
Поверхность алюмосиликатов еще более кислая, чем поверхность окиси алюминия, но эта кислотность менее чувствительна к отравлению водой. Много дискутировался вопрос о том, чем вызывается кислотность алюмосиликатов: бренстедовскими или льюисовскими кислотными центрами. Этот вопрос окончательно не решен, хотя имеются данные, указывающие, что присутствуют оба типа кислотных центров. Этим объясняется тот факт, что каталитическая активность в различных реакциях может быть селективно отравлена различными реагентами. [29]
Эти кажущиеся противоречия в результатах обусловлены неоднородностью поверхности окиси алюминия, которая содержит центры различной кислотной силы. [30]
Страницы: 1 2 3 4