Поверхность - нержавеющая сталь
Cтраница 3
Одновременное травление и окрашивание в темный цвет поверхности нержавеющих сталей достигается в растворе, содержащем 250 см3 концентрированной НС1 и 750 мл воды, в который добавляют 50 г нитрата висмута и 50 г теллуристой кислоты. [31]
В процессе хранения и при эксплуатации в атмосферных условиях поверхность нержавеющих сталей тускнеет и приобретает серый оттенок. При этом коррозионная стойкость металла не снижается, а следовательно, изменение внешнего вида поверхности не является браковочным признаком. [32]
Удаление окалины после термической обработки и других видов нагрева с поверхности нержавеющих сталей производится механическим способом или травлением. [33]
Как показал Окамото [7], скорость восстановления перекиси водорода на поверхности нержавеющей стали AIS1 - 304 относительно мала по сравнению с другими окислителями. Этот автор объясняет различия в поведении тех или иных окислителей, предполагая их разную способность к реакции на всей поверхности и на ее активных участках. [34]
Наиболее полные исследования, подтвердившие существование окисной пассивной пленки на поверхности нержавеющих сталей, выполнены Г. В. Акимовым и его школой. [35]
Колеса сварной конструкции выполнены из стали 1X13 для обеспечения чистоты поверхности нержавеющей стали. В этом случае лопатки фрезеруются за одно целое с телом диска колеса и снабжены шипами, входящими в пазы покрывающего диска. Шипы провариваются в покрывающем диске, затем подвариваются концы лопаток. [36]
 |
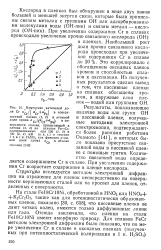
Зависимость потери массы образцов ( Дт от концентрации H2S04 после 20 - ч испытаний. [37] |
В патенте показано, что при длительном хранении кремниймолибдено-вой кислоты на поверхности нержавеющей стали образуются прочные пленки молибдатов железа, хрома и никеля. Если в качестве гетерополи-кислоты применяется кремнийвольфрамовая кислота, то образуются пленки вольфраматов железа, хрома и никеля. [38]
Структура исследуется методом электронной дифракции на отражение для пленок непосредственно на поверхности нержавеющих сталей или на просвет для пленок, отделенных с поверхности. [40]
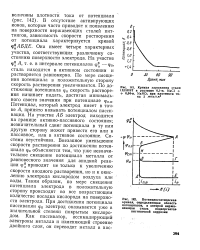
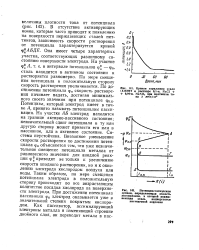
В отсутствие активирующих ионов, которые часто приводят к появлению на поверхности нержавеющих сталей пит-тингов, зависимость скорости растворения от потенциала характеризуется кривой р АБДЕ. Она имеет четыре характерных участка, соответствующих различному состоянию поверхности электрода. По мере смещения потенциала в положительную сторону скорость растворения увеличивается. По достижении потенциала фп скорость растворения начинает падать, достигая минимального своего значения при потенциале фп. Потенциал, который электрод имеет в точке А, принято называть потенциалом пассивации. На участке АБ электрод находится на границе активно-пассивного состояния; незначительный сдвиг потенциала в ту или другую сторону может привести его или в пассивное, или в активное состояние. Внезапное уменьшение скорости растворения по достижении потенциала фп объясняется тем, что уже незначительное смещение потенциала металла от равновесного значения для анодной реакции ф приводит не только к увеличению скорости анодного растворения, но и к окислению электрода кислородом воздуха или воды. Таким образом, по мере смещения потенциала электрода в положительную сторону происходит во все возрастающем количестве посадка кислорода на поверхности электрода. При достижении потенциала пассивации фп электрод оказывается уже в значительной степени покрытым кислородом. [42]
В отсутствие активирующих ионов, которые часто приводят к появлению на поверхности нержавеющих сталей пит-тингов, зависимость скорости растворения от потенциала характеризуется кривой ц АБДЕ. Она имеет четыре характерных участка, соответствующих различному состоянию поверхности электрода. [44]
При высоких температурах ( более 600 С) наблюдается заметное науглероживание поверхности нержавеющих сталей, особенно поверхности сталей, легированных сильными карбидо-образующими элементами, например титаном. Науглероживание усиливается при наличии углеродсодержащих материалов в системе и может сопровождаться переносом углерода в ней. [45]
Страницы: 1 2 3 4