Поверхность - свинцовый электрод
Cтраница 1
Поверхность свинцовых электродов заметно поддается коррозии. Свинцовый электрод, который раньше был использован в электрохимическом восстановлении метилэтилкетона, во время чего он разъедался с образованием тетраизобутилсвинца, дал. Кроме того, на поверхность свинцовых электродов вредное влияние оказывают электролиты, содержащие органические кислоты или соединения, гидролизующиеся с образованием таких кислот. [1]
Поверхность свинцовых электродов заметно подвергается коррозии. Кроме того, электролиты, содержащие органические кислоты или соединения, которые подвергаются гидролизу с образованием кислот, оказывают вредное действие на поверхность свинцовых электродов. [2]
Изучение изменения поверхности свинцовых электродов методами измерения емкости электрического двойного слоя и по кривым катодной поляризации показало, что поверхность свинцового анода разрыхляется в ходе электролиза. Добавки к электролиту, указанные в таблице 37 и увеличивающие разрушение анодов, также увеличивают и его поверхность, а добавки, уменьшающие разрушение, уменьшают поверхность. [3]
Образование нерастворимого сульфата свинца на поверхности двуокисно-свинцовых и свинцовых электродов, разряжающихся в сернокислом электролите, уменьшает коэффициенты использования их активных веществ, особенно при разряде на низких температурах. Применение для этой электродной пары электролита, в котором легко растворимы свинцовые соли, образующиеся при разряде, позволяет улучшить использование активных веществ; электроды в этом случае могут изготовляться из монолитной беспористой массы. Удаление продуктов разряда с поверхности электродов понижает, кроме того, их концентрационную поляризацию, позволяя расширить пределы рабочих плотностей тока. Такой электролит должен представлять собой сильную и относительно концентрированную кислоту, обладающую низкой температурой замерзания. Он не должен окислять активное вещество отрицательного электрода или восстанавливать двуокись свинца. Свинцовые соли этой кислоты должны иметь высокую растворимость во всем рабочем интервале температур. Наиболее подходящими электролитами являются растворы хлорной кислоты НС1О4, бор фтористоводородной НВ. [4]
Но PbSO4 мало растворим и покрывает поверхность свинцового электрода тонким слоем, препятствующим дальнейшему взаимодействию свинца с кислотой, a Pb ( SO4) 2 весьма сильно гидролизован, так что равновесие второй реакции смещено влево. [5]
Второй путь сводился к нанесению на поверхность гладких свинцовых электродов пасты, приготовленной из окислов свинца. Благодаря высокой пористости получаемого из пасты активного материала процесс формирования протекал очень быстро. Однако из-за опадания массы на дно сосуда срок службы этих аккумуляторов был невелик. [6]
Снятие кривых заряжения и параллельное измерение емкости двойного слоя, которая в этом случае в первом приближении пропорциональна свободной поверхности металла, показали, что поверхность гладкого свинцового электрода во время анодной пассивации равномерно во времени покрывается изолирующим слоем кристалликов сульфата свинца. Между прочим, этим было опровергнуто необоснованное предположение В. Мюллера о росте пленки сернокислого свинца в толщину после окончания роста в ширину, лежащее в основе его во многом неправильной теории пассивации. Возрастание потенциала свинца при анодной поляризации постоянным током ( кривая 2, рис. 1) объясняется не увеличением сопротивления в порах, что также является допущением теории В. [7]
Так, например, если электролиз серной кислоты производится на платиновых электродах, то величина потенциала разложения здесь будет меньше, чем при электролизе H2S04, на свинцовых электродах. Это объясняется тем, что образующиеся в процессе электролиза водород и кислород с поверхности свинцовых электродов удаляется в виде элементарных Нг и С2 гораздо труднее, чем с платиновых. [8]
Поверхность свинцовых электродов заметно подвергается коррозии. Кроме того, электролиты, содержащие органические кислоты или соединения, которые подвергаются гидролизу с образованием кислот, оказывают вредное действие на поверхность свинцовых электродов. [9]
Поверхность свинцовых электродов заметно поддается коррозии. Свинцовый электрод, который раньше был использован в электрохимическом восстановлении метилэтилкетона, во время чего он разъедался с образованием тетраизобутилсвинца, дал. Кроме того, на поверхность свинцовых электродов вредное влияние оказывают электролиты, содержащие органические кислоты или соединения, гидролизующиеся с образованием таких кислот. [10]
В процессах электролиза, протекающих с выделением газа, кроме диффузионного потенциала и химической поляризации возникает так называемое перенапряжение, обусловленное задержкой газа на поверхности электрода при его выделении из раствора. Так, например, если электролиз серной кислоты производится между платиновыми электродами, то величина потенциала разложения здесь будет меньше, чем при электролизе H2SO4 между свинцовыми электродами. Это объясняется тем, что образующиеся в процессе электролиза водород и кислород с поверхности свинцовых электродов удаляются в виде элементарных Н2 и О2 гораздо труднее, чем с платиновых. [11]
В процессах электролиза, протекающих с выделением газа, кроме диффузионной и химической поляризации, возникает перенапряжение, обусловленное задержкой газа на поверхности электрода при его выделении из раствора. Так, если электролиз серной кислоты производится на платиновых электродах, то величина потенциала разложения будет меньше, чем при электролизе H2SO4 на свинцовых электродах. Это объясняется тем, что образующиеся в процессе электролиза водород и кислород с поверхности свинцовых электродов удаляются в виде элементарных Н2 и О2 гораздо труднее, чем с платиновых. [12]
Рассмотрим сначала процесс формировки поверхностных пластин, а затем уже решетчатых. Если вести формировку по способу Плантэ, погружая пластину в раствор серной кислоты и постепенно наращивая слой РЬСЬ, то процесс идет очень медленно. Для ускорения наращивания РЬОз погружают положительные свинцовые электроды на несколько часов в раствор азотной кислоты; при этом получается разрыхление поверхности свинцового электрода, что вызывает более быстрое наращивание активной массы. [13]
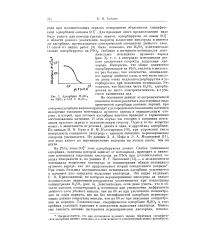 |
Адсорбция H2S04 на РЬ02 в 0 01 / V HaS04. [14] |
На основании данных эл ектрохимической кинетики можно различать два основных вида химической адсорбции анионов: первый, при котором адсорбция анионов приводит к ускорению восстановления катионов вследствие смещения потенциала нулевого заряда в отрицательную сторону, и второй, при котором адсорбция анионов приводит к торможению восстановления катионов. В этом случае мы говорим о смещении потенциала нулевого заряда в положительную сторону. Одно и то же вещество может, в зависимости от условий, давать и один, и другой вид адсорбции. По данным Н. Я. Бунэ и Я. М. Колотыркина [10], при упрочении связи поверхности свинцового электрода с анионом снижение перенапряжения водорода уменьшается. Иофа и Л. А. Медведевой [11], ион иода влияет на перенапряжение водорода на железе иначе, чем на ртути. [15]
Страницы: 1 2