Поверхность - потенциальная энергия
Cтраница 2
Поверхность потенциальной энергии, изображенная на рис. 88, была вычислена именно при этих условиях, причем предполагалось, что ку-лоновская энергия составляет Ю / 0 от полной энергии связи. При этом энергия активации получается равной 8 8 ккал. Если предположить, что кулоновские энергии связей С - Н и С - С составляют 14 / 0 от полной энергии, то для энергии активации реакции между этиленом и водородом получается лучшее согласие с экспериментом. При этом же условии для энергии активации при адсорбции водорода на углероде получается значение 5 6 ккал. [16]
 |
Рассчитанные энергии аллила а. [17] |
Поверхность потенциальной энергии для такого процесса, имеющая минимум для симметричного или почти полностью симметричного аллила, приведена на рис. 2 в статье Палдуса и Вейларда [72], которые изучали также неустойчивость решений уравнений Хартри - Фока. [18]
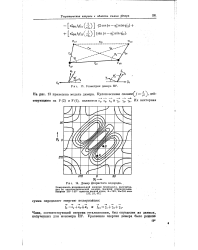 |
Геометрия димера HP. На 13 приведена модель димера. Кулоновскими силамиГ / -. дей.| Димер фтористого водорода. [19] |
Поверхность потенциальной энергии ( ккал / моль), рассчитанная по электростатической модели. [20]
На поверхности потенциальной энергии найдено два минимума, строение которых показано на рис. 2.2. Симметричный комплекс А характеризуется большей энергией димеризации ( - 29.3 кДж / моль против - 24.7 кДж / моль для комплекса Б), однако энтропия равновесия [ - 124 Дж / моль К ( А) и - 111 Дж / моль К ( Б) ] нивелирует предпочтительность комплекса А так, что расчетные значения константы равновесия в интервале 298 - 373 К для обоих комплексов практически совпадают. Высокий дипольный момент структуры Б ( 2.7 D) может служить дополнительным фактором стабилизации этого комплекса в полярных растворах. Инверсия комплексов А и Б протекает через переходные состояния, также стабилизированные водородными связями. [21]
Когда поверхность потенциальной энергии имеет два минимума, естественно возникает вопрос о высоте разделяющего их барьера и о скорости миграции протона между ними. Скорость перехода протона в принципе можно определить релаксационными методами, быстро смещая положение таутомерного равновесия путем изменения внешнего параметра и измеряя скорость релаксации системы. Однако в случае комплексов с водородной связью типа ОН - - N пока не известно ни одного примера успешного измерения такого рода. К такому же выводу приходят теоретики при расчетах скорости перехода протона в одномерных двойных потенциальных ямах с различными высотой барьера и расстоянием между ямами. Например, по данным работы [127], при достаточно реальном расстоянии, которое необходимо пройти протону, возможно эффективное туннелирование с частотой порядка 1013 сект1 даже через довольно высокий барьер - 5 ккал / молъ над нулевым ур овнем. [22]
Когда поверхность потенциальной энергии имеет два минимума, естественно возникает вопрос о высоте разделяющего их барьера и о скорости миграции протона между ними. Скорость перехода протона в принципе можно определить релаксационными методами, быстро смещая положение таутомерного равновесия путем изменения внешнего параметра и измеряя скорость релаксации системы. Однако в случае комплексов с водородной связью типа ОН - - N пока не известно ни одного примера успешного измерения такого рода. К такому же выводу приходят теоретикипри расчетах скоростипереходапротонаводно-мерных двойных потенциальных ямах с различными высотой барьера и расстоянием между ямами. Например, по данным работы [ 1271, при достаточно реальном расстоянии, которое необходимо пройти протону, возможно эффективное туннелирование е частотой порядка 1013 сек 1 даже через довольно высокий барьер - 5 ккал / моль над нулевым уровнем. [23]
Построить поверхности потенциальной энергии в общем случае весьма сложно; это делается лишь для небольшого числа очень простых реакций, и то весьма приближенно. [24]
Если поверхность потенциальной энергии известна достаточно детально, то коэфициенты Ь можно определить непосредственно. Считая, что кулоновская ( аддитивная) энергия составляет 14 / 0 от полной энергии связи, получаем, что координаты активированного состояния равны rt 1 25 А и г2 0 78 А. [25]
Построить поверхности потенциальной энергии в общем сл у - I чае весьма сложно; и это делается лишь для небольшого числа / очень простых реакций и то весьма приближенно. [26]
 |
Графическое определение резонансной энергии в активированном состоянии. [27] |
Пусть поверхность потенциальной энергии рассматриваемой реакции изображается рис. 43, на котором сечение / показывает изменение потенциальной энергии молекулы YZ в зависимости от расстояния Y - Z, когда атом X находится далеко от YZ. [28]
Пересечение поверхностей потенциальной энергии, соответствующих ofj и j) 2, требует, чтобы Ег Ev Однако это может быть справедливым, если только взаимодействие Н 12 равно нулю. [29]
Расчеты поверхностей потенциальной энергии явным или неявным образом осуществляются для газовой фазы. В растворе на-до рассматривать столь большое число межъядерных координат, которое с трудом поддается обработке. [30]
Страницы: 1 2 3 4