Реакционная поверхность
Cтраница 3
Стеклообразный диселенид кремния ввиду меньшей реакционной поверхности более химически стоек, чем кристаллический - Однако вода разлагает его при комнатной температуре, а концентрированная серная кислота растворяет с зеленым окрашиванием при продолжительном нагревании. Водный раствор NaOH быстро разлагает стеклообразный диселенид кремния с образованием красного раствора полиселенида натрия. [31]
Обозначим через Sis площадь реакционной поверхности раздела, отнесенную к единице массы исходного реагента. Величина этой площади зависит, естественно, от степени превращения твердого вещества. [32]
Стремление максимально повысить температуру реакционной поверхности углерода топлива приводит к применению топочных устройств и газогенераторов, работающих с жидким шлакоудале-нием. [33]
При подаче газа через сопла реакционная поверхность растет пропорционально расходу газа до максимальной частоты образования пузырьков. Дальнейшее повышение расхода газа ведет к увеличению размеров пузырьков и к соответствующему уменьшению удельной поверхности. При этом реакционная поверхность возрастает медленнее, чем увеличивается расход газа. Дальнейшее повышение расхода газа ведет к уменьшению числа пузырьков вследствие их слияния. [34]
В процессе растворения соли на реакционные поверхности камеры, расположенные под небольшими углами к горизонту, осаждаются нерастворимые включения, снижающие скорость растворения соли. При толщине слоя 2 - 4 см массообменные процессы на таких поверхностях практически прекращаются. [35]
Скорость реакции зависит от температуры реакционной поверхности и начальной концентрации. Представим себе, что мы разожгли канал, в каком-то месте, отдаленном от входного сечения на расстояние х ( см. рис. 72), так что на некотором участке канала после розжига установилось некоторое распределение температур 0, и одновременно производим подачу воздуха в канал. Для того чтобы понять условия передвижения зоны горения, нужно вспомнить упомянутые три условия теплового воспламенения, сформулированные Вант-Гоффом ( см. гл. [36]
Наряду с диффузией деполяризатора к реакционной поверхности ( или от нее) на изменение его концентрации могут влиять химические реакции, протекающие у поверхности электрода. Измеряемый в этом случае сигнал несет информацию о кинетике химических реакций. В случае быстрых химических реакций ( контролируемые диффузией процессы) измеряется только диффузионное перенапряжение [76, 109], в случае медленных реакций - также и перенапряжение сопутствующих химических реакций. [37]
Особенно благоприятные условия для развития реакционной поверхности раздела возникают вблизи фазовых переходов, когда природа дефектности кристаллов носит ярко выраженный флуктуа-ционный характер. Этим и объясняются высокие скорости превращения в подобных системах. [38]
Можно сказать, что величина реакционной поверхности раздела зависит от полной истории реакции и даже от ее предыстории. Рассмотрим кратко те способы, с помощью которых можно описать начальные стадии развития реакции, основываясь на законах образования и развития реакционной поверхности раздела. Речь будет идтиг разумеется, о реакциях, протекающих в неизменных экспериментальных условиях, так как изменение последних в ходе процесса может существенно исказить наблюдаемое явление, если эти изменения по-разному влияют на образование и продвижение поверхности раздела. [39]
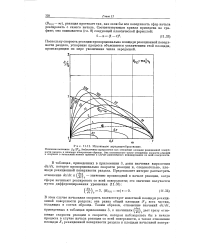 |
Мгновенное зародышеобразование. [40] |
Поскольку скорость реакции пропорциональна площади реакционной поверхности раздела, ускорение процесса объясняется увеличением этой площади, происходящим по мере увеличения числа зародышей. [41]
Применение метода непрерывного обновления всей реакционной поверхности твердого металлического электрода под раствором электролита при одновременном исследовании кинетики электродного процесса ( снятии поляризационных кривых) позволяет сделать определенный вывод о характере тормозящих стадий электродного процесса. [42]
Применение метода непрерывного обновления всей реакционной поверхности твердого металлического электрода под раствором электролита при одновременном исследовании кинетики электродного процесса позволяет дать количественную оценку степени торможения электродного процесса отдельными его ступенями. Торможение электродного процесса от тех ступеней, скорость которых определяется адсорбцией или образованием защитных пленок, устраняется при непрерывном обновлении поверхности электрода. Наоборот, торможени-ступеней, зависящих от процесса передачи зарядов, не снимается при обновле нии поверхности. [43]
Образование двухмерных фаз, блокирующих реакционную поверхность, нельзя считать особенностью систем жидкость - жидкость. Это явление широко распространено в катализе. [44]
Далее, необходимо подчеркнуть, что реакционная поверхность вскипающего металла увеличивается вместе со скоростью обезуглероживания, так как при этом растет число образующихся пузырьков. Это не учтено в уравнении ( VI, 128), так же как и периодичность вскипания. [45]
Страницы: 1 2 3 4