Удельная поверхность - угль
Cтраница 1
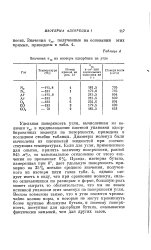 |
Значения г ив изотерм адсорбции на угле. [1] |
Удельная поверхность угля, вычисленная из величин vm, в предположении плотной упаковки адсорбированных молекул на поверхности, приведена в последнем столбце таблицы. Диаметры молекул были вычислены из плотностей жидкостей при соответствующих температурах. Правда, изотерма бутана, измеренная при 0, дает удельную поверхность примерно на 25 % меньше среднего значения, полученного из изотерм пяти газов табл. 4, однако следует иметь в виду, что при сравнении молекул, сильно отличающихся по размерам и форме, большую роль может сыграть то обстоятельство, что мы не знаем истинной упаковки этих молекул на поверхности угля. Весьма возможно также, что в угле имеются чрезвычайно мелкие поры, в которые не могут проникнуть более крупные молекулы бутана, и поэтому поверхность, доступная для адсорбции бутана, оказывается фактически меньшей, чем для других газов. [2]
Удельная поверхность углей составляет 400 - 900 м2 / г. Измельчение угля, освобождая его внутреннюю поверхность, приводит к возрастанию скорости адсорбции. В исследованиях Б. В. Ильина и А. В. Киселева [13], в случае адсорбции из растворов при низких концентрациях измельчение от d0 68 мм до d0 15 мм вызвало ускорение поглощения примерно в шесть раз. [3]
Удельная поверхность углей может составлять от долей квадратного метра до 400 м2; для ее определения используют изменение теплоты смачивания и метод низкотемпературной сорбции азота и аргона. [4]
Если удельная поверхность угля измеряется по данным адсорбции азота и к опытным изотермам типа I применяется метод БЭТ, то полученные значения часто оказываются заниженными. Поскольку метод БЭТ, как мы видели, дает обычно завышенные значения для микропористых адсорбентов, полученные величины относятся скорее к высшему пределу, чем к низшему. Когда, однако, удельную поверхность рассчитывают из теплот смачивания в метаноле ( см. гл. В дальнейшем было показано, что значения удельной поверхности, вычисленные из данных об адсорбции газов, заметным образом зависят от температуры и обычно возрастают с увеличением температуры. Это справедливо не только для азота, но и для других адсорбатов при условии, что размеры их молекул не слишком велики. В табл. 49 представлены данные о влиянии температуры на вычисленные значения удельной поверхности. Для данного угля значения 5, вычисленные по адсорбции азота, при - 183 значительно выше, чем при - 196, а значения S, вычисленные по адсорбции бутана при 20, еще выше, несмотря на то что молекулы бутана больше молекул азота. [5]
Определение удельной поверхности углей и углеродсодержащих веществ сложно, поскольку их поверхность значительно изменяется в зависимости от степени пиролиза и сухой перегонки. [6]
Вычисление удельной поверхности угля проводят следующим образом. [7]
При вычислении удельной поверхности угля или кокса предполагают, что величина адсорбции в расчете на единицу их поверхности при данном давлении такая же, как и на саже. [8]
Приблизительное представление об удельной поверхности угля при размоле может дать следующий пример. [9]
О несоответствии величин удельной поверхности углей, вычисленных по изотермам адсорбции аргона при - 183 и из определений теплот смачивания, сообщали также Цвитеринг, Оле и Ван-Кревелен [122], но они относили это за счет дополнительного выделения тепла в результате набухания угля. [10]
Метод сорбции газов в случае, например, азота дает возможность вычислять размеры удельной поверхности углей различной структуры, включая и набухающие угли. [11]
Это показывает, что в случае крупнопористых углей адсорбционные методы позволяют правильно оценить удельную поверхность углей. [12]
В целом ряде работ ( их обзор дан, например, в [45, 92]) проведено сопоставление величин удельных поверхностей углей с развитой переходной пористостью и дисперсных углеродных материалов, измеренных разными способами. В табл. 4 сопоставлены величины удельных поверхностей некоторых саж, определенных различными методами. Как видно, во всех случаях имеет место удовлетворительное соответствие между данными различных измерений, в том числе и по адсорбции из раствора. [13]
Воулд с сотрудниками [88] обнаружили, что при адсорбции додецилсульфата натрия на углях различной зольности величина адсорбции возрастает с увеличением содержания золы, хотя удельная поверхность углей остается почти одной и той же. На основании этих экспериментальных данных авторы предположили, что на полярных участках поверхности угля, содержащих золу, длинноцепочечные ионы адсорбируются избирательно, образуя двойной адсорбционный слой, и что адсорбция происходит в соответствии с изотермой Ленгмюра, до тех пор пока равновесная концентрация не достигнет ККМ, после чего становится возможной адсорбция мицелл. В этой критической точке на кривой возникает перелом При увеличении концентрации ПАВ возрастает ионная сила, толщина поверхностного двойного слоя уменынаетсяи адсорбционный слой приобретает структуру поверхностной мицеллы; этот переход соответствует максимуму на кривой. Последующее уменьшение адсорбции обусловлено, по-видимому, разрушением поверхностных мицелл при их столкновении с мицеллами в объемной фазе. [14]
Воулд с сотрудниками [88] обнаружили, что при адсорбции додецилсульфата натрия на углях различной зольности величина адсорбции возрастает с увеличением содержания золы, хотя удельная поверхность углей остается почти одной и той же. На основании этих экспериментальных данных авторы предположили, что на полярных участках поверхности угля, содержащих золу, длинноцепочечные ионы адсорбируются избирательно, образуя двойной адсорбционный слой, и что адсорбция происходит в соответствии с изотермой Ленгмюра, до тех пор пока равновесная концентрация не достигнет ККМ, после чего становится возможной адсорбция мицелл. В этой критической точке на кривой возникает перелом. При увеличении концентрации ПАВ возрастает ионная сила, толщина поверхностного двойного слоя уменьшается и адсорбционный слой приобретает структуру поверхностной мицеллы; этот переход соответствует максимуму на кривой. Последующее уменьшение адсорбции обусловлено, по-видимому, разрушением поверхностных мицелл при их столкновении с мицеллами в объемной фазе. [15]
Страницы: 1 2 3