Истинная поверхность - электрод
Cтраница 2
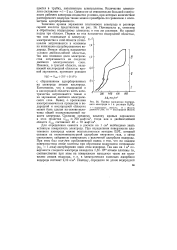 |
Кривая заряжения платинового электрода в 1 н. растворе H2SO4. [16] |
Для определения емкости в расчете на 1 см2 необходимо знать истинную поверхность электрода. При определении поверхности платинового электрода можно воспользоваться методом БЭТ, который основан на низкотемпературной адсорбции инертного газа, а затем сопоставить найденную поверхность с величиной адсорбции водорода. При этом был получен приближенный вывод о том, что на каждом поверхностном атоме платины при обратимом водородном потенциале ( рн2 1 атм) адсорбирован один атом водорода. [17]
Для определения емкости в расчете на 1 м2 необходимо знать истинную поверхность электрода. При определении поверхности платинового электрода можно воспользоваться методом БЭТ, который основан на низкотемпературной адсорбции инертного газа, а затем сопоставить найденную поверхность с величиной адсорбции водорода. При этом был получен приближенный вывод о том, что на каждом поверхностном атоме платины при обратимом водородном потенциале ( / 7н20, 1 МПа) адсорбирован один атом водорода. Поэтому, определяя по длине водородной области количество Надс при обратимом водородном потенциале в сернокислом растворе, можно легко рассчитать истинную поверхность исследуемого электрода. [18]
Платиновые электроды покрываются бархатисто-черной мелко раздробленной платиной ( платиновой чернью) для увеличения истинной поверхности электродов и для облегчения адсорбции газов платиной, содействующей диссоциации молекул водорода и облегчению передачи электронов. [19]
Нами было сделано предположение, что это снижение перенапряжения водорода на хроме связано с возрастанием величины истинной поверхности хромового электрода. [21]
Все-потенциалы даны относительно водородного электрода в том же растворе, все токи и скорости отнесены к единице истинной поверхности электрода. [22]
Все потенциалы даны относительно водородного электрода в том же растворе, все токи и скорости отнесены к единице истинной поверхности электрода. Следует отметить, что измерения окисления и адсорбции муравьиной кислоты в растворах с рН 8 очень трудно проводить из-за нестабильности токов, быстрого отравления электрода какими-то неокисляющимися частицами, образующимися при каталитическом разложении муравьиной кислоты при контакте раствора с платиной. В кислых растворах при достаточно высокой концентрации муравьиной кислоты ( больше 0 5 М) этот процесс также наблюдается, но идет с очень малой скоростью и приводит лишь к некоторым искажениям зависимостей в этих растворах. [23]
По-видимому, на ход поляризационной кривой в условиях образования на металле объемистого осадка сульфида железа определенное влияние может оказать изменение истинной поверхности электрода. Это также должно вести к повышению кривой катодной поляризации и к росту скорости коррозии, так как известно, что с увеличением истинной поверхности электрода понижается перенапряжение выделения водорода. [24]
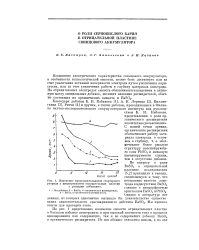 |
Изменение продолжительности стартерного разряда с циклировапием отрицательных пластин с разными добавками. [25] |
Повышение электрических характеристик свинцового аккумулятора, в особенности технологической ем: кости, может быть достигнуто или за счет увеличения истинной поверхности электрода путем увеличения пористости, или за счет увеличения работы в глубину материала электрода. [26]
А - поверхность одной стороны пластины конденсатора, a D - диэлектрическая постоянная среды), - некоторые авторы определяли с большей или меньшей долей приближения истинные поверхности электродов. [27]
Количественная интерпретация данных о свойствах двойного слоя, полученных на серебре, в настоящее время еще не представляется возможной в связи с тем, что величина истинной поверхности использованных электродов значительно отличалась от видимой. [28]
Однако количество выделяющегося при этих потенциалах водорода весьма незначительно и трудно уловимо аналитическим методом, тем более, что в интервале потенциалов Е3 - Et заметно ухудшается качество гальваноосадков серебра и увеличивается истинная поверхность электрода. [29]
Итак, скорость электрохимических реакций увеличивают, а поляризацию элементов снижают путем: а) применения эффективных катализаторов электрохимического процесса ( электрокатализаторов); б) повышения рабочей температуры; в) увеличения истинной поверхности электрода и, в частности, применения пористых электродов оптимальной структуры; г) повышения концентрации реагентов в растворе или давления газообразных реагирующих веществ; д) применения принудительной подачи реагентов. [30]
Страницы: 1 2 3 4