Повышение - концентрация - водородный ион
Cтраница 1
Повышение концентрации водородных ионов: в процессе конденсации мочевины с формальдегидом может происходить: от окисления формальдегида в муравьиную кислоту кислородом, воздуха, от взаимодействия формальдегида со свободной щелочью ( реакция Каиницаро), от превращения мочевины в цианат аммония. [1]
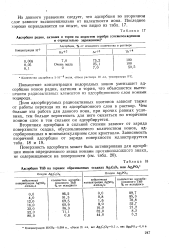 |
Адсорбция ThB на заранее образованных осадках Ag2C204 или Ag3P04. [2] |
Повышение концентрации водородных ионов уменьшает адсорбцию ионов радия, актиния и тория, что объясняется вытеснением радиоактивных элементов из адсорбционного слоя ионами водорода. [3]
С повышением концентрации водородных ионов скорость коррозии в растворах кислот возрастает. Однадо это справедливо только по отношению к кислотам, не являющимся окислителями, в которых процесс коррозии протекает с образованием растворимых продуктов коррозии, как например при коррозии железа в соляной кислоте. В кислотах же, которые являются окислителями ( в азотной или концентрированной серной кислоте), с повышением их концентрации скорость коррозии увеличивается в тех случаях, когда кислород играет роль деполяризатора ( действие HNOs на Си), и уменьшается, когда на поверхности металла образуются нерастворимые продукты коррозии. В последнем случае коррозия практически прекращается. [4]
С повышением концентрации водородных ионов ( рН4) и снижением ее ( рН 11) коррозия алюминиевых сплавов резко ускоряется. [6]
 |
Влияние рН раствора, содер - [ IMAGE ] II Влияние концентрации. [7] |
С повышением концентрации водородных ионов ( рН4) и снижением ее ( рН 11) коррозия алюминиевых сплавов резко ускоряется. В растворах с рН5 - 11 преимущество в коррозионной стойкости сплавов системы Al-Zn-Mg перед сплавами Д16 и АК8 особенно значительно. [8]
Увеличение окислительной способности перманганата при повышении концентрации водородных ионов является прямым следствием закона действия масс ( стр. [9]
Среда должна быть щелочной, так как повышение концентрации водородных ионов способствует увеличению растворимости карбонатов. Наиболее удобно в данном случае нейтрализовать аммиаком. [10]
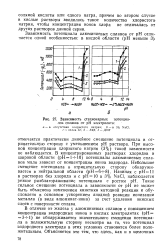 |
Зависимость стационарных потенциалов сплавов от рН электролита. [11] |
В отличие от железа у алюминиевых сплавов с повышением концентрации водородных ионов в кислых электролитах ( рН 3 - М) не обнаруживается значительного смещения потенциала в положительную сторону несмотря на то, что потенциал водородного электрода в этих условиях становится более положительным. [12]
Зная окислительный потенциал этой реакции ( который, как показывает уравнение, возрастает с повышением концентрации водородных ионов), можно вычислить условия, при которых будет происходить окисление гидрохинона или восстановление хинона. В приблизительно нейтральном растворе гидрохинон окисляется иодом количественно ( см. гл. Другие хиноны ведут себя аналогично паре хинон - гидрохинон. Также подобно этой паре, хотя и несколько более сложно, поведение системы: цистин - цистеин. [13]
При контроле процесса коррозии металлов по скорости водородной деполяризации увеличение скорости коррозии может быть достигнуто повышением концентрации водородных ионов, смещающих потенциал водородного электрода в положительную сторону и уменьшающих перенапряжение водорода в концентрированных растворах сильных кислот. Этим методом следует пользоваться только в том случае, когда металл находится в активном состоянии. [14]
Стремление ионной атмосферы Н - катионита к рассеянию в растворителе и способность ее в процессе такого рассеяния совершать работу повышения концентрации водородных ионов в пограничном электронейтральном растворе кислоты может трактоваться как упругость ионной атмосферы Н - катионита. Величина этой упругости в момент возникновения ионной атмосферы ( или, что то же самое, в момент ее исчезновения, так как процесс диссоциации ионита является обратимым) можетбытьназвана упругостью диссоциации ионита. [15]
Страницы: 1 2 3
