Повышение - концентрация - водородный ион
Cтраница 2
Эту оптимальную концентрацию водородных йогов необходимо во время осаждения поддерживать постоянной, так как при осаждении винного камня под действием хлорида калия происходит повышение концентрации водородных ионов. [16]
Эрдей-Груз и Фольмер ( 1930 г.), исходя из предположения замедленности стадии разряда водородных ионов и предполагая, что разряду подвергаются не все ионы, но лишь наиболее активные, концентрация которых является постоянной при t const и в сильном поле определяется экспоненциальной функцией, пришли к заключению об ограниченной скорости разряда ионов, требующей для своего увеличения либо повышения концентрации активных водородных ионов, либо снижения требуемого уровня энергии активации. [17]
Качество электролитических покрытий часто зависит от кислотности раствора, которая характеризуется концентрацией в нем водородных ионов. С повышением концентрации водородных ионов кислотность раствора повышается и наоборот. [18]
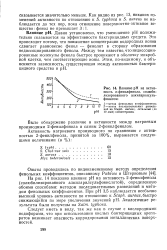 |
Влияние рН на активность о-фенилфенола, солюби-1 лизированного алкиларилсуль. [19] |
Давно установлено, что уменьшение рН положительно сказывается на эффективности бактерицидных средств. Это происходит потому, что повышение концентрации водородных ионов сдвигает равновесие фенол - фенолят в сторону образования недиссоциированного фенола. Между тем известно, что недиссоциированные молекулы фенола быстрее проникают в оболочку микробной клетки, чем соответствующие ионы. [20]
Эфпры кар боковых и сульфокислот весьма сильно различаются по скорости гидролиза. Скорость гидролиза алкилсульфонатов мало изменяется при повышении концентрации водородных ионов [200] раствора, тогда как для эфиров карбоно-вых кислот скорость гидролиза имеет минимум в слабо кислой области. [21]
Эфиры карбоновых и сульфокислот весьма сильно различаются по скорости гидролиза. Скорость гидролиза алкилсульфонатов мало изменяется при повышении концентрации водородных ионов [200] раствора, тогда как для эфиров карбоновых кислот скорость гидролиза имеет минимум в слабо кислой области. [22]
В целях повышения эффективности использования ионитов весьма важным является правильный их выбор. При этом необходимо учитывать, что слабокислотные катиониты по мере повышения концентрации водородных ионов в растворе теряют способность ионизироваться и обменивать их на другие катионы. [23]
В целях повышения эффективности использования ионитов весьма важным является правильный их выбор. При этом необходимо учитывать, что слабокислотные катиониты по мере повышения концентрации водородных ионов в растворе теряют способность ионизироваться и обменивать их на другие катионы. [24]
Константа Kw имеет большое значение в аналитической химии, помогая разобраться в процессе Нейтрализации кислот и оснований. Вода, находясь на воздухе, поглощает двуокись углерода, что ведет к повышению концентрации водородных ионов за счет образования угольной кислоты. Концентрация водородных ионов может возрасти при этом в - 20 раз. Вода же, хранящаяся в стеклянной посуде, растворяет стекло, приобретая щелочную реакцию. [25]
Константа Kw имеет большое значение в аналитической химии, помогая разобраться в процессе нейтрализации кислот к оснований. Вода, находясь на воздухе, поглощает двуокись углерода, что ведет к повышению концентрации водородных ионов за счет образования угольной кислоты. Концентрация водородных ионов может возрасти при этом в - 20 раз. Вода же, хранящаяся в стеклянной посуде, растворяет стекло, приобретая щелочную реакцию. [26]
 |
Ток пассивации и критическая концентрация окислителя Fe3, необходимые для пассивации титана в кипящих растворах H2SO4, содержащих постоянное количество ( 5 % NasSO. [27] |
Наличие галоидных ионов, в первую очередь хлор-ионов, так же, как и повышение концентрации водородных ионов, для большинства металлов затрудняет переход в пассивное состояние. В этом случае повышение агрессивности среды приводит к увеличению плотности предельного тока пассивации, и концентрация окислителя, необходимая для пассивации металла, может заметно повышаться, а в отдельных случаях перевод системы в пассивное состояние вовсе не достигается. [28]
Из диаграммы можно также сделать вывод, что чем сильнее поляризуется электрод в данной системе, тем слабее его влияние на другие электроды многоэлектродной системы. Факторы, способствующие уменьшению катодной поляризации, например введение в раствор легко восстанавливающихся окислителей, повышение концентрации водородных ионов, перемешивание электролита, увеличение площади катодов, усиливают роль наиболее электроположительных членов многоэлектродной системы, способствуя переводу. Уменьшение поляризуемости сильных анодов, увеличение их площади или введение в систему более электроотрицательного анода, наоборот, способствует переводу промежуточных электродов в катоды. Увеличение анодной поляризуемости наиболее электроотрицательных металлов системы может привести к тому, что металлы, работавшие раньше в качестве катодов, начнут функционировать в качестве анодов. [29]
Из диаграммы можно также сделать вывод, что чем сильнее поляризуется электрод в данной системе, тем слабее его влияние на другие электроды многоэлектродной системы. Факторы, способствующие уменьшению катодной поляризации, например введение в раствор легко восстанавливающихся окислителей, повышение концентрации водородных ионов, перемешивание электролита, увеличение площади катодов, усиливают роль наиболее электроположительных членов многоэлектродной системы, способствуя переводу промежуточных электродов в аноды. Уменьшение поляризуемости сильных анодов, увеличение их площади или введение в систему более электроотрицательного анода, наоборот, способствует переводу промежуточных электродов в катоды. Увеличение анодной поляризуемости наиболее электроотрицательных металлов системы может привести к тому, что металлы, работавшие раньше в качестве катодов, начнут функционировать в качестве анодов. [30]
Страницы: 1 2 3