Повышение - кратность - связь
Cтраница 1
Повышение кратности связи углерод - углерод резко сказывается на ее длине. [1]
Повышение кратности связи приводит к упрочению межатомной связи и к уменьшению межъядерного расстояния. [2]
 |
Разные способы изображения а - и я-связей в ацетилене. [3] |
С повышением кратности связи становятся короче. [4]
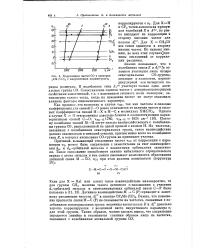 |
Корреляция частот СО в спектрах jXM ( С0 5 с индуктивным параметром оч. [5] |
Важно, что повышение кратности связи М - С ( F) не сказывается на частотах, связанных с колебаниями экваториальных групп: величины частот полос Е и А довольно хорошо коррелируются с величиной чисто индуктивного параметра а / для этой группы. Таким образом, можно сделать вывод, что сопряжение передается линейно и сказывается главным образом лишь на частотах, связанных с колебаниями аксиальной группы СО. [6]
Из этих данных следует, что повышение кратности связи одинаковыми атомами повышает энергию СБЯЗИ, но это повышение не пропорционально увеличению числа связей. [7]
Расстояние между атомами углерода по мере повышения кратности связи уменьшается и составляет соответственно 0 1543; 0 1353 и 0 1205 нм. [8]
 |
Энергетическая схема образования молекулы кислорода О2. [9] |
Уменьшение числа разрыхляющих электронов приводит к повышению кратности связи ( число связывающих электронов становится больше числа разрыхляющих уже не на четыре, а на пять) и, следовательно, к образованию более прочной молекулы. Именно поэтому энергия диссоциации молекулярного иона О. [10]
 |
Энергетическая схема образования молекулы кислорода Ог.| Энергетическая схема образования молекулы оксида углерода СО. [11] |
Уменьшение числа разрыхляющих электронов приводит к повышению кратности связи ( число связывающих электронов становится больше числа разрыхляющих уже не на четыре, а на пять) и, следовательно, к образованию более прочной молекулы. Именно поэтому энергия диссоциации молекулярного иона OJ выше, чем энергия диссоциации молекулы 02 ( см. стр. [12]
 |
Энергетическая схема образования молекулы кислорода О2.| Энергетическая схема образо вания молекулы окиси углерода СО. [13] |
Уменьшение числа разрыхляющих электронов приводит к повышению кратности связи ( число связывающих электронов становится больше числа разрыхляющих уже не на четыре, а на пять) и, следовательно, к образованию более прочной молекулы. Именно поэтому энергия диссоциации молекулярного иона OJ выше, чем энергия диссоциации молекулы О2 ( см. стр. [14]
 |
Энергетическая схема образования молекулы оксида углерода СО. [15] |
Страницы: 1 2 3