Повышение - кратность - связь
Cтраница 3
Однако значительно более разнообразны молекулы и комплексные ионы, средняя кратность ( порядок) связи в которых больше единицы. Повышение кратности связи обязано наложению на 0-связь л - и б-связей. [31]
Однако значительно более разнообразны молекулы и комплексные ионы, средняя кратность ( порядок) связи в которых больше единицы. Повышение кратности связи обязано наложению на ог-связь л - и б-связей. [32]
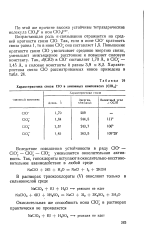 |
Характеристика связи СЮ в анионных комплексах [ С10П ]. [33] |
Возрастающая роль r - связывания отражается на средней кратности связи СЮ. Повышение кратности связи СЮ увеличивает среднюю энергию связи, уменьшает межъядерное расстояние и повышает силовую константу. [34]
ЙГвесь этих молекул ( 2 9 мдин / А. Такое же повышение кратности связей происходит при переходе от тетра-эдрического иона BeF ( 3 5 мдин / А. [35]
 |
Энергетические диаграммы уровней двухатомных молекул. [36] |
Как видно из рисунка, по мере заполнения связывающих орбиталей энергия диссоциации молекул увеличивается, а с появлением электронов на разрыхляющих орбиталях уменьшается. Из рисунка также видно, что удаление электрона с разрыхляющей орбитали приводит к повышению кратности связи и, как следствие этого, увеличению энергии диссоциации и уменьшению межъядерного расстояния. [37]
Повышение частоты при обезвоживании, по-видимому, означает сохранение концевой роли кислорода и некоторое повышение кратности связи его с металлом при потере трямс-партнера. [38]
При образовании молекул наблюдается наложение валентных связей. На a - связи возможно наложение я - и б-связи, что приводит к повышению кратности связи, образованию двойных и тройных связей. Это сказывается на изменении длины и энергии связи. Тройная связь возникает, как известно, при образовании молекулы азота. При достаточном сближении атомов азота ( Is22s22 / r) две рж-орбитали ( см. 3.6) перекрываются, образуя общее электронное облако, расположенное вдоль оси, соединяющей ядра атомов. [39]
Представляет определенный интерес сопоставление стереохимии четырех родственных по составу соединений: рассмотренного только что Re2Cl5 ( ( CH3) 2 ( CH2) 2S2), описанного выше Re2Cl4 ( CH3COO) 2 ( H2O) 2, еще не упоминавшегося Re2OCl3 ( C2H5COO) 2 ( PPri3h и рассмотренного в предыдущем разделе ReCU. Удаление одного электрона при переходе от первого соединения ко второму приводит к замене скрещенной конфигурации на заслоненную и к повышению кратности связи Re-Re от тройной до четверной. Удаление еще одного электрона приводит к более существенной перестройке структуры димерного комплекса. Мостиковую функцию, помимо двух групп RCOO, выполняют атомы С1 и О. [40]
Страницы: 1 2 3