Повышение - полярность - растворитель
Cтраница 3
Макромолекулы полярных полимеров, находящиеся в слабо-полярном растворителе, непрерывно изменяют свою форму, приближаясь к равновесному состоянию-вытянутой цепочке. Чем выше полярность структурных звеньев, тем больше вытягиваются цепи макромолекул и уменьшается число их конформациий. С повышением полярности растворителя возрастает сила взаимодействия его молекул с отдельными звеньями макромолекул полярного полимера. Это приводит к образованию сплошной соль-ватной оболочки вокруг макромолекулы и уменьшению взаимного отталкивания ее звеньев, что увеличивает подвижность цепей. [31]
У некоторых веществ, представляющих исключение, при увеличении полярности растворителя наблюдается не понижение, а повышение частоты валентных колебаний. Таким необычным соединением является нитрозилхлорид, исследованный в наших лабораториях. При повышении полярности растворителя наблюдается дальнейшее смещение полосы поглощения в более высокочастотную область. [32]
 |
Значения Др / а для 50 % - ного переноса протона по данным ИК-спектро. [33] |
Другим фактором, влияющим на положение равновесия, описываемого уравнением (4.1), является окружение водородно-связанного комплекса. Будучи ди-польным взаимодействием, водородная связь оказывается наиболее прочной в самых неполярных растворителях. Можно ожидать, что повышение полярности растворителя должно благоприятствовать образованию ионной пары при прочих одинаковых факторах. [34]
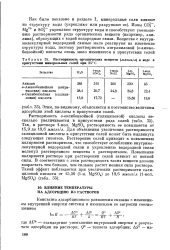 |
Растворимость органических веществ ( ммоаь / л в воде в присутствии минеральных солей при 25 С. [35] |
Для объяснения увеличения растворимости салициловой кислоты в присутствии солей может быть выдвинута следующая гипотеза. Растворение солей приводит к повышению полярности растворителя, что способствует ослаблению внутримолекулярной водородной связи и укреплению водородной связи молекул растворенного вещества с растворителем. Повышение полярности раствора при растворении солей зависит от ионной силы. В соответствии с этим растворимость таких веществ должна возрастать тем больше, чем сильнее растет ионная сила раствора. [36]
Более полярное окружение повышает скорость любой реакции, которая идет по механизму, включающему ионные ин-термедиаты. При наличии нейтральных, уходящих групп ожидается, что реакциям Е1 и ElcB будет способствовать повышение полярности растворителя и его ионной силы. [37]
В первом случае растворяющая способность растворителя повышается вследствие взаимодействия диполя с полярными, а также легко поляризующимися углеводородами. Во втором случае повышение растворяющей способности происходит за счет диспер -, сионных сил, действие которых распространяется на полярные S и неполярные углеводороды фракции нефти. И в том и в другом случаях повышение растворяющей способности растворителя сопровождается уменьшением егр селективности. Однако при повышении полярности растворителя селективность его уменьшается не так значительно, как при введении неполярной группы. [38]
На рис. 2 приведена принципиальная схема галогенирования олефи. Процесс начинается с образования молекулярных комплексов с переносом заряда. Последующее превращение комплексов может происходить по ионному, молекулярному или радикально-цепному пути. Ионному направлению реакции благоприятствует повышение полярности растворителя и активности олефина. В неполярных растворителях преобладает молекулярный и радикально-цепной путь реакции. Малоактивные олефшш в основном галогенируются по радикальному механизму. [39]
Несмотря на довольно большое время жизни синглетной ионной пары в системе a - MST - TCNB, ее диссоциация на свободные ионы не обнаружена. В этом случае ионная пара, образованная в результате переноса заряда в состоянии Sp имеет время жизни около 100 не в дихлорметане, а также в 1 2-дихлорэтане. Кроме того, сингл етная ионная пара в данной системе довольно эффективно диссоциирует на свободные ионы. Выход и скорость диссоциации возрастают при повышении полярности растворителя. [40]
Поскольку в апротонных биполярных растворителях ( по крайней мере, в начале реакции) невозможно образование водородных связей с анионными основаниями, основность меняется иначе, чем в протонных растворителях ( см. разд. В согласии с обсужденными выше отношениями ( см. разд. Так как при этом образуется-гал oreноводород, реакция может стать обратимой: целесообразно ввиду этого проводить реакцию в основном биполярном апротонном растворителе, например в диметилформамиде. В протонных растворителях наблюдаются закономерности, обсуждавшиеся в предыдущей главе: повышение полярности растворителя благоприятствует 8гД / Е1 - реакции. [41]
Страницы: 1 2 3