Повышение - скорость - коррозия
Cтраница 2
При использовании температурного фактора как средства повышения скорости коррозии при испытании необходимо учитывать характер протекающего процесса. При дальнейшем повышении температуры резко уменьшается растворимость кислорода, что приводит к снижению скорости коррозии. [16]
Приведенные выше данные также показывают, что повышение скорости коррозии при увеличении агрессивности среды или наложении анодной поляризации далеко не всегда вызывает непрерывное повышение скорости коррозионного растрескивания; гораздо чаще наблюдается некоторое ( иногда значительное) первоначальное увеличение скорости растрескивания, которое сменяется спадом ее. [17]
В результате электрохимических исследований установлено, что причина повышения скорости коррозии - активирование поверхности металла в присутствии грибов, в том числе легко пассивируемых в обычных условиях металлов. Например, сплавы свинец-олово ( 10 % олова) и алюминиевые ( В-95) в присутствии Aspergitlus niger и Trichoderma lignorum подвергались значительной коррозии, причем образцы из сплава свинец-олово полностью разрушались за 15 сут. [18]
При использовании в ускоренных коррозионных испытаниях температурного фактора как средства повышения скорости коррозии необходимо учитывать характер протекающего процесса. [19]
При использовании в ускоренных коррозионных испытаниях температурного фактора как средства повышения скорости коррозии необходимо учитывать характер протекающего процесса. Повышение температуры - важный фактор, определяющий скорость коррозии. [20]
В случае медьсодержащих сплавов присадка окислителей и продувание кислородом действуют отрицательно, способствуя повышению скорости коррозии этих сплавов. [21]
Комплексообразующие вещества, обычно такие как ЕДТА цианиды и сильные щелочи, способствуют повышению скоростей коррозии многих металлов вследствие снижения активности ионов металлов, что значительно сдвигает потенциалы металлов в отрицательную сторону. [22]
В 88 % - ной фосфорной кислоте ( кривая 2) у ниобия наблюдается две области повышения скорости коррозии. Первая, при потенциалах, близких к стационарному значению, характеризующая активное состояние ниобия. Далее отмечается узкая область, несколько положительнее стационарного значения потенциалов, в которой скорость коррозии ниобия уменьшается благодаря образованию на его поверхности стабильных анодных пленок [61], и затем область более положительных потенциалов ( до 4 0 в), где наблюдается увеличение скорости коррозии ниобия. [23]
Другой пример относится к случаю использования титана в контакте со средой, содержащей фтор-ионы, которые всегда приводят к повышению скорости коррозии титана. Так, в производстве хладонов на узле нейтрализации абгазов была установлена титановая колонна диаметром 500 мм и высотой 7350 мм. По регламенту в колонну подаются газы, содержащие [ % ( масс.) ]: Н2О - 1, HF - 0 1, С12 - 8, остальное - органика. Орошение осуществляется 20 % - ным раствором NaOH при температуре 40 - 60 С. Из-за повышенной концентрации Районов по сравнению с регламентной срок службы колонны не превышает 6 мес. [24]
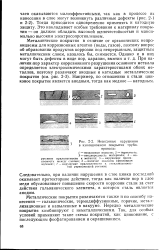 |
Невидимые нарушения в изоляционном покрытии трубопровода. [25] |
Следовательно, при наличии нарушения в слое цинка последний оказывает протекторное действие, тогда как наличие пор в слое меди обусловливает повышение скорости коррозии стали за счет действия гальванического элемента, в котором сталь является анодом. [26]
Многие другие факторы, например, присутствие в воде некоторых газов, наличие на металлической поверхности локальных осадков или окалины и развитие бактерий, также могут способствовать повышению скорости коррозии. Приведенное ясно показывает, что для успешного моделирования коррозионной проблемы в лабораторных условиях и преодоления коррозии знание всех специфических особенностей коррозионной системы является совершенно необходимым. [27]
 |
Схема гдиффузии кислорода неэлектролите к микрокатода л. а-а - граница диффузионного слоя в электролите. К - микрокатоды. Me - корродирующий металл. [28] |
Если в особо чистый металл вводить катодные примеси или структурные составляющие, то в условиях контроля катодного процесса диффузией кислорода это приведет, согласно уравнению ( 499), к увеличению путей диффузии кислорода и повышению скорости коррозии металла. Однако начиная с некоторой сравнительно низкой степени загрязненности катодными примесями, которая свойственна техническим металлам, дальнейшее увеличение катодных примесей или структурных составляющих мало влияет на скорость процесса. [29]
Увеличение в ИПС концентрации соляной кислоты от 0 1 до 1 % не оказывает существенного влияния на коррозионную стойкость титана и его сплавав, в то время как у сталей при больших концентрациях соляной кислоты наблюдается повышение скорости коррозии. Нержавеющие стали неодинаково корродируют в жидкой и паровой фазах одного и того же раствора. Так, в жидкой фазе раствора ИПС 1 % НС1 коррозия сталей 14Х17Н, 14Х17Н2 и 06ХН28МДТ имеет равномерный характер, при этом поверхность образцов тускнеет. После испытания образцов этих сталей в паровой фазе на их поверхности развивается местная коррозия. С увеличением концентрации соляной кислоты в растворе диаметр местных разрушений ( язв) на поверхности образцов увеличивается. При увеличении времени испытания наблюдается развитие язвы в глубь образца. Язвенная коррозия стали 06ХН28МД после испытания в паровой фазе раствора ИПС 1 % НС1 невелика. Коррозионная стойкость титана и его сплавов практически одинакова в паровой и жидкой фазах, и при визуальном осмотре поверхности образцов после испытания их в растворе ИПС с добавками НС1 не обнаружено каких-либо изменений. [30]
Страницы: 1 2 3 4