Повышение - скорость - коррозия
Cтраница 3
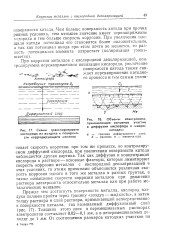 |
Схема транспортировки кислорода из воздуха к поверхности корродирующего металла. [31] |
Так как диффузия и концентрация кислорода в растворе - основные факторы, которые лимитируют скорость коррозии металлов с кислородной деполяризацией в этих условиях, то этими причинами объясняется различная скорость коррозии одного и того же металла в разных грунтах, а также повышение скорости коррозии металлов при движении раствора электролита относительно металла или при работе металлических мешалок. [32]
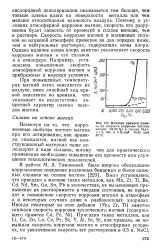 |
Влияние примеси железа на скорость коррозии чистого магния ( 99 99 % и сплава Мд 1 % Мп в 3 % - ной NaCl при 25 С. [33] |
Было установлено, что присадки к магнию таких металлов, как Mn, Zr, Ti, Be, Cd, Nd, Sm, Ga, Sn, Pb в количествах, не вызывающих превышение их растворимости в твердом состоянии, не приводят к повышению скорости коррозии магния в атмосфере и в некоторых случаях даже в разбавленных хлоридах. [34]
Увеличение минерализации электролита в двухфазной системе ведет к росту скорости коррозии углеродистой стали. Повышение скорости коррозии в присутствии сульфата железа может быть объяснено своеобразным влиянием двухвалентных ионов железа, которые при небольшом изменении рН электролита в тонком слое способствуют более быстрому образованию на поверхности металла осадда сульфида железа, стимулирующего коррозию. [35]
Она резко повышается при рН 6, сохраняется постоянной до рН - 3 и затем снижается, оставаясь, однако, на порядок выше по сравнению с щелочными растворами. Повышение скорости коррозии при переходе от щелочных к кислым растворам обусловлено тем, что НСЮ сильнее взаимодействует с графитом по сравнению с С10 - - ионом. Энергия активации реакции графита с СЮ - и НСЮ составляет 50 4 и 96 6 кДж / моль соответственно. [36]
Этот пример также показывает, какое большое влияние оказывает комплексообразованле на скорость коррозии. Повышение скорости коррозии в присутствии комплексообразователя связано с ускорением процесса анодного растворения. Формально это связано со сдвигом анодной поляризационной кривой в отрицательную сторону. [37]
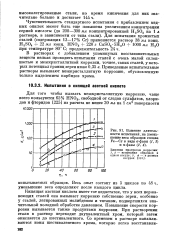 |
Влияние длительности испытаний на уменьшение веса образцов сплава Fe-Сг в виде а-фазы ( 1, 3 и а-фазы ( 2, 4. [38] |
Кипящая азотная кислота имеет тот недостаток, что у всех нержавеющих сталей она вызывает коррозию собственно зерен, особенно у сталей, легированных молибденом и титаном, подвергшихся значительной холодной обработке давлением. Повышение скорости коррозии вызывается также продуктами коррозии. При растворении стали в раствор переходит двухвалентный хром, который затем окисляется до шестивалентного. [39]
При среднеэксшгуатационной скорости коррозии ( без учета водных обмывок), равной 1 0 - 1 2 г / ( м2 - ч), такой режим обмывок сокращает срок службы холодного слоя РВП примерно вдвое. Помимо повышения скорости коррозии набивки РВП водная обмывка усиливает коррозионные разрушения газоходов котла, примыкающих к воздухоподогревателю, и требует организации мероприятий по нейтрализации сточных вод перед сбросом в канализацию. [40]
Пунктиром намечено повышение скорости коррозии в концентрированных щелочах. [41]
Как показывают кривые катодной поляризации, резкое увеличение скорости коррозии в кислых средах вызвано облегчением катодной реакции восстановления водорода без изменения стационарных электродных потенциалов. В щелочной области повышение скорости коррозии сопровождается резким разбла-гораживанием потенциалов, что обусловлено растворением окисной пленки на поверхности сплава и переходом его в активное состояние. Коррозия металлов в сильно щелочных средах происходит за счет катодной реакции ионизации кислорода, поэтому потенциал активированной поверхности смещается в отрицательную сторону до тех пор, пока не будет достигнуто перенапряжение реакции выделения водорода из молекулы воды, соответствующее катодной плотности тока при данном значении рН среды. [42]
 |
Влияние рН раствора, содер - [ IMAGE ] II Влияние концентрации. [43] |
В результате электрохимических исследований установлено, что увеличение скорости коррозии в кислых средах связано с облегчением катодной реакции восстановления водорода. В щелочной среде повышение скорости коррозии алюминиевых сплавов сопровождается резким разблагораживанием потенциалов, вызванным растворением окисной пленки на поверхности сплава и переходом его в активное состояние. В сильнощелочных средах потенциал активированной поверхности смещается в отрицательную сторону до тех пор, пока не достигается потенциал выделения водорода из молекул воды. [44]
Метод и режимы испытаний должны обеспечивать условия протекания коррозионного процесса в течение значительной части времени с большей скоростью. Существует несколько методов повышения скорости коррозии. Применительно к атмосферной - коррозии или случаям периодического воздействия электролита на металл наиболее простым является увеличение времени воздействия электролита на металл. [45]
Страницы: 1 2 3 4