Дальнейшее повышение - потенциал
Cтраница 3
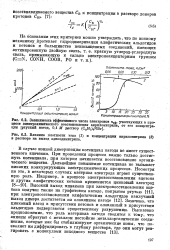
В случае ионной димеризации потенциал катода не имеет существенного значения. При проведении процесса важно только достигнуть потенциала, при котором начинается восстановление органического вещества. Дальнейшее повышение потенциала не вызывает никаких конкурирующих электрохимически процессов. Несмотря на это, в некоторых случаях материал электрода играет существенную роль. [32]
В случае ионной димеризации потенциал катода не имеет существенного значения. При проведении процесса важно только достигнуть потенциала, при котором начинается восстановление органического вещества. Дальнейшее повышение потенциала не вызывает никаких конкурирующих электрохимических процессов. Несмотря на это, в некоторых случаях материал электрода играет существенную роль. Замечено, что цинковый катод в присутствии кетонов и оловянный в присутствии альдегидов подвергаются существенному разрушению. [34]
В случае ионной димеризащш потенциал катода не имеет существенного значения. При проведении процесса важно только достигнуть потенциала, при котором начинается восстановление органического вещества. Дальнейшее повышение потенциала не вызывает никаких конкурирующих электрохимических процессов. Несмотря на это, в некоторых случаях материал электрода играет существенную роль. Замечено, что цинковый катод в присутствии кетонов и оловянный в - присутствии альдегидов подвергаются существенному разрушению. [36]
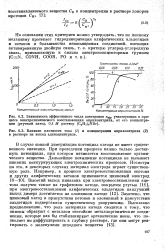
При росте потенциала в пленке появляется примесь Cr ( VI), что приводит к улучшению ее защитных свойств. Степень гидратации пленки уменьшается. Дальнейшее повышение потенциала приводит к образованию высших оксидов хрома. Эти оксиды анодно или химически образуют хроматы, переходящие в раствор. [37]
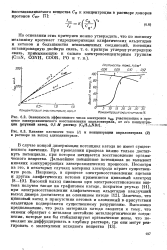
Этот эффект должен быть выражен сильнее всего в том случае, когда поверхность электрода почти полностью заполнена, и катионы оказывают максимальное влияние в области перехода от одной тафе-левской зависимости к другой. Кроме того, в условиях полного покрытия поверхности окисной пленкой должна облегчаться адсорбция катионов, что ведет к повышению перенапряжения в переходной области. Дальнейшее повышение потенциала препятствует адсорбции катионов; поэтому их влияние уменьшается. Влияние катионов при малых плотностях тока очень мало, потому что в этой области специфическая адсорбция анионов выражена слабее, чем при более положительных потенциалах. Как указал Фрумкин [141], это объяснение следует рассматривать как предварительное, однако оно соответствует фактам. [38]
При росте потенциала в пленке появляется примесь Cr ( VI), что приводит к улучшению ее защитных свойств. Степень гидратации пленки уменьшается. Дальнейшее повышение потенциала приводит к образованию высших оксидов хрома. Эти оксиды анодно или химически образуют хроматы, переходящие в раствор. [39]
 |
Сеточная характеристика. [40] |
При некотором значении сеточного напряжения Uc U t пролетевшие сквозь сетку электроны приобретают в ускоряющем поле энергию, достаточную для ударной ионизации молекул газа. Анодный ток 1а при этом возрастает скачком до значения, зависящего преимущественно от сопротивления внешней цепи. Дальнейшее повышение потенциала сетки не вызывает изменения анодного тока. Следовательно, сетка теряет свои управляющие свойства. [41]
В сухом негорячем воздухе оксидный барьер весьма устойчив, но с водой атомы металла могут образовывать, помимо пассивирующих оксидов, растворимые катионы. Однако при нек-ром критич. С дальнейшим повышением потенциала скорость растворения сначала снижается в тысячи и миллионы раз, затем в нек-ром интервале значений потенциала остается приблизительно постоянной, а выше определ. [42]
В подобных условиях коррозионная стойкость металлов близка к стойкости при предыдущем потенциале и металлы располагаются в точно такой же ряд. Наблюдается дальнейшее возрастание скорости окисления молибдена. Следует отметить, что рассматриваемый потенциал соответствует концу пассивной области для хрома и никеля. При дальнейшем повышении потенциала эти металлы переходят в область перепассивации. Несмотря на это, вплоть до потенциала 1 2 в их скорости остаются меньше скорости растворения железа и, следовательно, отрицательное влияние этих металлов на коррозионную стойкость сплавов на основе железа еще не должно проявляться. [43]
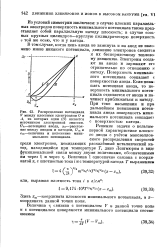
Электроны оседают на аноде и заряжают его отрицательно по отношению к катоду. Поверхность минимального потенциала совпадает с поверхностью анода. Если повышать потенциал анода, то поверхность минимального потенциала отделяется от анода и начинает приближаться к катоду. При токе насыщения и при дальнейшем повышении потенциала анода поверхность минимального потенциала совпадает с поверхностью катода. [45]
Страницы: 1 2 3 4