Закись - марганец
Cтраница 3
Гидрат закиси марганца с кислотами образует соответствующие соли двухвалентного марганца, в щелочах же не растворяется, так как обладает только основными свойствами. [31]
Соль закиси марганца легко растворима в холодной воде; при нагревании такого раствора выделяется обильный аморфный осадок, снова легко переходящий в раствор при его охлаждении. [32]
Соли закиси марганца в кристаллическом состоянии, а также и в растворах окрашены в бледнюрозовый цвет; в безводном состоянии все соли закиси марганца, за исключением сульфида, белого цвета. [33]
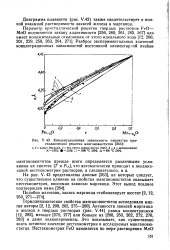 |
Концентрационная зависимость параметра кристаллической решетки мангановюститов ( 263. [34] |
Активности закисей марганца и железа в твердых растворах ( рис. V.44) равны концентрациям [12, 282], меньше [275, 277] или больше их [208, 250, 262, 272, 276, 283] и даже знакопеременны. Это показывает, как существенно знать истинное значение нестехиометрии в исследуемых мангановю-ститах. [35]
Соли закиси марганца в кристаллическом состоянии, а также и в растворах окрашены в бледнюрозовый цвет; в безводном состоянии все соли закиси марганца, за исключением сульфида, белого цвета. [36]
Гидрат закиси марганца применяют для определения малых количеств кислорода, которые не могут определяться ни фосфором, ни другими обычными способами. Свежеприготовленный гидрат закиси марганца в виде белого осадка в водном растворе прекрасно поглощает кислород, окисляясь до гидрата окиси марганца, имеющей коричневый цвет. При обработке гидроокиси йодистым калием и серной кислотой освобождается иод и раствор окрашивается в розовый цвет. При взбалтывании раствора с 100 см3 газа легко определяются следы кислорода. Определение может быть не только качественным, но и количественным. Для этого свободный иод оттитровывают тиосульфатом натрия. [37]
Устойчивость закиси марганца к окиАяющему действию кислорода воздуха увеличивается с повышением температуры получения закиси. [38]
Соли закиси марганца обеих кислот на холоду также хорошо растворимы в воде; однако растворимость их, особенно для изокамфокамфорной кислоты, сильно понижается при нагревании. [39]
Соль закиси марганца легко растворима в холодной воде; при нагревании такого раствора выделяется обильный аморфный осадок, снопа легко переходящий в раствор при его охлаждении. [40]
 |
Растворимость ниобата натрия ( соль в воде и растворах едкого натра. [41] |
Метаниобат закиси марганца Mn ( NbO3h может быть получен способом, аналогичным приведенному выше для соли железа. [42]
Гидрат закиси марганца Мп ( ОН) 2 получают действием щелочей на растворы солей двухвалентного марганца. Он имеет основной характер. [43]
Гидрат закиси марганца Мп ( ОН) а в природе встречается в виде п и р о-х р о и т а; приготовляется осаждением из солей двувалентного Мп едкими щелочами. В свежеосажденном состоянии - аморфный белый порошок, к-рый на воздухе быстро буреет вследствие окисления; при высушивании на воздухе переходит в закись-окись марганца. Применяется под названием марганцевого бистра в качестве краски в фарфоровом производстве и в ситцепечатном деле. [44]
Соль закиси марганца метилкамфорной кислоты в холодной воде довольно хорошо растворима, при нагревании же растворимость этой соли уменьшается, хотя и не столь резко, как в случае кислоты камфорной. Соли щелочные и щелочноземельные метилкамфорной кислоты легко растворимы в воде. [45]
Страницы: 1 2 3 4