Подвижность - кислород
Cтраница 3
Таким образом, установлено, что усложнение состава катализаторов, способствующее повышению активности и селективности окисления углеводородов, изменяет подвижность кислорода и энергию связи кислорода в решетке твердого тела. V, посвященной активной поверхности, еще раз рассмотрено состояние кислорода и его участие в реакциях окисления углеводородов. [31]
Я думаю, что С. Ю. Еловил прав, когда считает, что в значительной мере механизм окислительных процессов зависит от подвижности кислорода в окислах, которая в свою очередь зависит от условий получения катализаторов и проведения реакции. Во всяком случае сам факт получения диаметрально противоположных результатов для одной и той же реакции, но в несколько разных условиях, позволяет предположить принципиальную возможность протекания процесса окисления как с участием кислорода контакта, так и без него. Все зависит от конкуренции этих двух возможностей. [32]
В заключение следует остановиться на вопросе о соотношении между частными зависимостями изменения энергий промежуточного взаимодействия при катализе, а именно подвижности кислорода различных окислов, и электронной структурой катализаторов. Существование такой связи очевидно. Так, в рассматриваемом случае связывание и отщепление кислорода включает электронные переходы при превращении молекул в атомарные ионы и обратно п энергия промежуточного взаимодействия должна зависеть от работы выхода катализатора. К сожалению, однозначно связать изменение работы выхода и каталитической активности в ряду исследованных катализаторов нам не удалось. По-видимому, это отражает общую закономерность. [33]
Баттахайра и Гулати [177] окисляли толуол на ванадиевых контактах; они сравнивали активности различных контактов по хемо-сорбции кислорода и считали, что должна существовать связь между подвижностью кислорода на поверхности V20s и ее каталитической активностью. Суворов и Рафиков исследовали реакцию окисления тетралина и декалина в паровой фазе над окислами ванадия и на основании анализа продуктов реакции высказали предположение, что дегидрирование является обязательной стадией окисления би-циклических нафтеновых и терпеновых углеводородов. В литературе почти не освещен вопрос о влиянии строения окисляемых молекул углеводородов на механизм процесса. Основные продукты неполного окисления толуола, этилбен-зола и кумола одинаковы - бензойная кислота и малеиновый ангидрид. В небольших количествах получаются хинон и следы фенола, гидрохинона, формальдегида и перекиси. В низкотемпературной области из С7Н8 и С8Н10 образуется бензальдегид, а из кумола - ацетофенон. [34]
Единственное известное отличие нашего способа получения Си2О от способа Гарнера с сотрудниками заключается в том, что для восстановления медноаммонийного сульфата до меди мы использовали аммиачный раствор гидразина, а они - смесь гидразина с каустической содой; возможно, что это привело к ясно выраженному различию в подвижности кислорода в Си2О, образующейся на поверхности меди. Весьма желательно повторное проведение этих исследований с одновременным применением как изотопного, так и калориметрического методов. [35]
Кислотно-основные свойства поверхности контакта играют, очевидно, решающую роль в механизме активации сероводорода. Поскольку подвижность кислорода поверхности глинозема, алюмосиликата, углерода очень низка, именно активация сероводорода на этих контактах обеспечивает высокую скорость его окисления. При рассмотрении реакции окисления сероводорода с этих позиций становится понятным, почему в ней в отличие от реакции окисления водорода, СО, аммиака, SO2 такие характеристики катализаторов, как наличие d - электронов, полупроводниковые свойства, электропроводность, наличие свободных d - орбита-лей, парамагнетизм не играют существенной роли. [36]
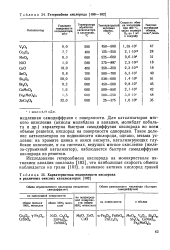 |
Гетерообмен кислорода.| Характеристика подвижности кислорода в различных окисных катализаторах. [37] |
Для катализаторов мягкого окисления ( окислы молибдена и ванадия, молибдат кобальта и др.) характерна быстрая самодиффузия кислорода во всем объеме решетки, кислород на поверхности однороден. Такое деление катализаторов по подвижности кислорода, однако, весьма условно: на хромите цинка и окиси висмута, катализирующих глубокое окисление, и на системах, ведущих мягкое окисление ( железо-сурьмяный катализатор), наблюдается быстрая самодиффузия кислорода из решетки. [38]
Гетерообмен кислорода на металлах изучен значительно меньше, чем на окислах. В табл. 30 приведены данные о подвижности кислорода на поверхности платины, палладия и серебра. В обмене кислорода на платине и палладии участвует очень мало атомов О, что указывает на более прочные связи кислорода с атомами Pt и Pd. На серебре практически весь кислород способен к обмену. Предполагается [94], что при взаимном превращении окислов серебра на его поверхности ( AgzO AgzOs) один из атомов кислорода входит в десорбируемую молекулу Oz и обусловливает обмен. Если же в обмене участвует поверхностный окисел типа Ад20г, в процессе принимают участие оба атома кислорода. [39]
Большая подвижность кислорода указывает на малую прочность его связи с кристаллической решеткой серебра. В кристаллических структурах обычных окисных катализаторов подвижность кислорода мала, а изотопный обмен кислорода начинается при температурах на 100 - 200 С выше температуры начала каталитической реакции65, тогда как на серебре изотопный обмен заметен как раз в диапазоне температур, в котором происходит окисление этилена. [40]
Роль аммиака и паров воды в процессе стабилизации точно не установлена. Возможно, пары воды способствуют стабилизации, увеличивая подвижность кислорода каркаса. Подвижность каркасного кислорода в присутствии паров воды очень велика, что должно облегчать дегидроксилирование, миграцию кремнезема и образование новых связей Si-0 - Si. Аммиак может так же, как и вода, увеличивать подвижность атомов каркаса, и, кроме того, его присутствие замедляет образование водородной формы цеолита. [41]
Стационарная активность н избирательность сложных систем в меньшей мере определяется состоянием кислорода максимально окисленной поверхности. Наблюдаемое в ходе катализа восстановление поверхности приводит к изменению подвижности кислорода и скорости реакций как суммарного, так и полного окисления будут определяться энергией его связи, соответствующей стационарному состоянию. Однако, стационарное состояние зависит от соотношения восстанавливающих и окисляющих компонентов реакционной среды и строго охарактеризовать его для последующего сравнения катализаторов затруднительно. [42]
В последнее время Брунс [203] высказал предположение, что окислительно-восстановительная схема процесса справедлива при наличии небольшого числа особо активных участков на поверхности контактов. В этом случае предел чувствительности изотопного метода не позволяет установить подвижность кислорода на этих центрах адсорбции и катализа. [43]
В литературе опубликован ряд исследований по изотопному кислородному обмену на окислах металлов - полупроводниках, и почти не имеется данных по кислородному обмену на металлических окислительных катализаторах - платине и серебре. Существенную роль в протекании процесса каталитического окисления различных веществ играет подвижность кислорода, адсорбированного на поверхности контактов, мерой которой является изотопный кислородный обмен. Марголис и Киселев [291 ] исследовали изотопный обмен кислорода на типичных окислительных контактах: металлическом серебре ( катализатор окисления этилена в окись этилена) с добавкой галоидов AgCl, AgJ и на окиси меди ( катализатор окисления пропилена в акролеин) с добавкой окислов лития, хрома, висмута и сернокислой меди. [44]
Хотя в рассмотренных выше случаях реакционная способность коррелирует с энергией связи кислорода, нельзя исключить возможность ускорения процесса и за счет активации второго компонента реакции - окисляющегося вещества. Очевидно, в данном случае введение серебра, хотя и повышает подвижность кислорода, ускоряет именно стадию активации ацетилена. [45]
Страницы: 1 2 3 4