Подвижность - кислород
Cтраница 4
Значительный интерес для установления механизма реакций образования силикатов представляет изучение диффузии кислорода в кремнеземе и кремнекислых соединениях. Хаул с сотрудниками показали, что в стекле пирекс при 540 С отсутствует подвижность кислорода. В очень тонком порошке кремнезема диффузия кислорода замечена при 500 - 600 С. В кварце диффузия кислорода обнаружена только при 1070 С. Коэффициент диффузии кислорода в тонких нитях из кварца равен 4 10 - 14 см2 / сек. [46]
Спектроскопические данные показывают, что под влиянием каталитического акта валентное состояние ионов изменяется и наблюдаются обратимые и необратимые изменения заряда на ионах участников реакция. Введение в катализаторы добавок ( модифицирование) увеличивает вероятность дополнительных электронных переходов и изменяет подвижность кислорода. Эти факторы влияют на селективность отдельных реакций при окислительных превращениях углеводородов. [47]
 |
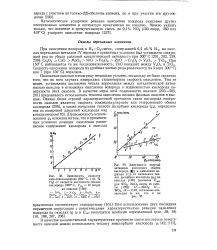
Зависимость активности и селективности промотированных ванадиевых катализаторов в реакциях окисления от электрического сопротивления. [48] |
В первом способе синтеза исходят из окислов с изолированными катионами решетки, высоким окислительным потенциалом и малой подвижностью кислорода в решетке. [49]
Положение окислов в этом ряду несколько условно, поскольку не было гарантии того, что во всех случаях измерялась стационарная скорость окисления. Тем не менее, установлена достаточно четкая корреляция между каталитической активностью окислов в отношении окисления водорода и подвижностью кислорода поверхности этих окислов. В качестве меры этой подвижности вначале [203-205, 241] предлагалось использовать теплоты окисления низших фазовых окислов в высшие. [51]
Таким образом, различные локальные свойства поверхности катализатора приводят к тому, что при низких температурах окисление СО на них осуществляется по разным механизмам и, следовательно, с разной скоростью. Благодаря этому часть СО образует с поверхностным кислородом поверхностные карбонатные комплексы так называемого гарнеров-ского типа [98-101], прочность которых зависит от подвижности кислорода поверхности. Поглощение СО катализатором ( с образованием карбонатных комплексов) постепенно уменьшается во времени. На образце NiO с относительно высокой подвижностью кислорода ( черной окиси никеля, приготовленной прокалкой NiCO3 при 400 С, с удельной поверхностью 45 м / г [104]) карбонатные комплексы, устойчивые при температуре 1729С, начинают распадаться при 275 С и полностью исчезают при температуре 388 С. [52]
В табл. 27 - 29 приведены скорости и энергии активации гете-рообмена кислорода на ванадий-титановых, ванадий-хромовых и железо-сурьмяных катализаторах разного состава. Введение 12 5 % ( масс.) двуокиси титана в пятиокись ванадия ( табл. 27) изменяет скорость обмена и значительно увеличивает энергию активации, что указывает на снижение подвижности кислорода в этой системе. [53]
Подвижность кислорода в решетке окислов в последнее время часто оценивается по скорости изотопного обмена твердого тела с газом. Работы Винтера и сотрудников [ 1J, Г. К. Борескова и Л. А. Касаткиной [2], С. М. Карпачевой и А. М. Розена [3] показали, что кинетика обмена имеет диффузионный характер; определяющей стадией обмена является степень подвижности кислорода в решетке окисла. Одной из существенных особенностей современных представлений в химии и физике полупроводников является представление о так называемых структурно чувствительных свойствах твердых тел. К таким свойствам относятся электропроводность, работа выхода и ряд других параметров, зависящих от предыстории твердого тела и его химического состава. Учение о полупроводниковых свойствах прежде всего основывается на картине реальной решетки с учетом локальных нарушений строго периодической структуры и отклонений от стехио-метрического состава. Эти нарушения в физике полупроводников могут быть охарактеризованы как при помощи метода электропроводности, так и другими способами. Большинство известных систем окислов-полупроводников ( Cu20, NiO, ZnO, Cr203, V20 - и др.) имеет нестехиометриче-ский состав. Естественно, что особенности химического и электронного состояния твердого тела должны определять подвижность ионов металла и металлоида и тем самым влиять на обмен между твердым телом и газом. Методы изучения подвижности ионов в решетке твердого тела в настоящее время еще недостаточно развиты и дифференцированы. Кроме того, при изучении подвижности до сих пор мало учитывали степень отклонения от стехиометрии в твердом теле. [54]
Одним из наиболее эффективных путей повышения селективности полного окисления углеводородов является, как и при мягком окислении, модифицирование поверхности катализаторов введением добавок. Их действие сводится 1) к изменению характера центров поверхности, на которых адсорбируется углеводород ( увеличение числа этих центров и изменение их валентного состояния), и 2) к росту подвижности кислорода в решетке. [55]
 |
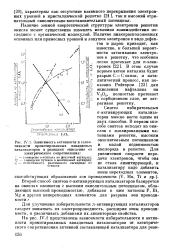
Теплота хемосорбции кислорода и энергия связи О - Me на пленках металлов. [56] |
Опубликовано много работ по адсорбции кислорода на различных твердых телах. В этих исследованиях освещаются в основном следующие вопросы: равновесие и кинетика адсорбции, неоднородность поверхности, растворение кислорода в решетке твердого тела, изменение электронных свойств полупроводников и металлов при адсорбции кислорода, подвижность кислорода на твердой поверхности. [57]
Страницы: 1 2 3 4