Закон - кинетика
Cтраница 2
Поскольку термическое разложение и восстановление водородом являются процессами неорганической технологии, подчиняющихся законам топохимической кинетики, установление последних в практическом плане имеет три выхода: 1) оптимизация технологических процессов производства катализаторов на этих стадиях; 2) выявление условий, способствующих повышению активности готового катализатора; 3) учет влияния условий процесса на пористую структуру и прочность готового катализатора. [16]
Это имеет большое значение дл я биологии, ибо в соответствии с законами кинетики, во много раз увеличивается скорость процессов ( в частности, ферментативных), идущих на границах раздела. [17]
Строго говоря, материальный расчет следовало бы проводить на основании данных стехиометрических уравнений я законов кинетики химических реакций. [18]
Обычно, если реакция между RX и AY термодинамически возможна, то ее направление определяется в первую очередь законами кинетики. [19]
Отсюда вытекает, что из реакций многих маршрутов только некоторые подчиняются закономерностям внешнедиффузионной области, а остальные протекают по законам обычной кинетики, что соответственно отражается на ходе процесса в целом и, в частности, на его селективности. [20]
Если в ходе приготовления катализатора меняется его фазовый состав, то имеем дело с топохимическими процессами, которые подчиняются законам топохимической кинетики. Соответственно с этим, научными основами получения катализаторов являются закономерности топохимических превращений неорганических веществ, сравнительно хорошо разработанные в области технологии силикатов. К сожалению, вследствие широкой номенклатуры катализаторов, ее изменчивости и относительно малой мощности пролзводств катализаторов топохимические основы этих производств разработаны пока недостаточно. [21]
Если скорость диффузии значительно меньше скорости реакции на поверхности раздела фаз, то процесс протекает в диффузионной области и подчиняется законам кинетики диффузии. Так как при понижении температуры скорость реакции убывает быстрее, чем скорость диффузии, то при низких температурах гетерогенный процесс, как правило, протекает в кинетической области. [22]
ЕнуТрй Kofopofo имеет место перенос тепла и массы, предполагается, что в том же условном объеме происходит горение по законам кинетики реакций. [23]
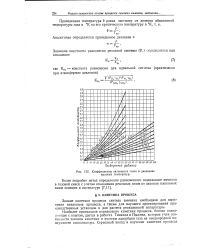 |
Коэффициенты активности газов в диапазоне высоких температур. [24] |
Наиболее правильное определение кинетики процесса, близко совпадающее с опытом, дается в работах Темкина и Пыжева, которые учли особенности законов кинетики и изотерм адсорбции газа на неоднородной поверхности катализатора. [25]
Как мы увидим далее, эти выражения дают быстрый способ решения дифференциального уравнения, описывающего кинетику процесса, для одного общего класса законов кинетики. [26]
Тейлор отметил, что процессы адсорбции при высоких температурах идут с измеримыми скоростями и что скорости увеличиваются с увеличением температуры, следуя законам кинетики, за исключением случаев, когда адсорбционные процессы имеют энергию активации. [27]
Эта же задача с учетом конечной скорости реакции решается при граничном условии на фронте, заключающем в себе равенство количества притекающей и сгорающей по законам кинетики ( порядок реакции, уравнение Аррениуса) смеси. В этом случае, как уже говорилось, из решения находятся также полнота сгорания и условия устойчивости существования фронта. Последние, как и обычно в теории теплового режима горения [ Вулис, 1954J, сводятся к анализу нелинейного уравнения, служащего в общей постановке задачи граничным условием для системы уравнений переноса. [28]
Вероятность взаимодействия между функциональными группами, принадлежащими разным макромолекулам, не зависит от величины и сложности их, но определяется только общей концентрацией функциональных групп в соответствии с обычными законами кинетики реакций низтхомолекулярных веществ. Вместе с тем реакции между функциональными группами, принадлежащими одной и той же макромолекуле, запрещены. [29]
Как видно из двух вышеприведенных примеров, предлагаемый нами вариант системы расчетов дает цифры, мало отличающиеся от цифр, получаемых по системе Карта, однако, в противоположность системе Карта, он соответствует законам кинетики химических реакций и не приводит к абсурдным отрицательным показателям. [30]
Страницы: 1 2 3