Закон - аррениус
Cтраница 2
В газах закон Аррениуса является отражением того факта, что согласно максвелл-больцмановскому распределению частиц газа по энергиям в реакцию может вступить лишь незначительная доля реакционноспособных молекул, отвечающая высокоэнергетическому хвосту распределения. Но и в хвосте, например, при теплоте активации Е в реакцию могут вступить молекулы с энергией Е / 2 каждая ( при равных массах молекул), движущиеся навстречу друг другу. При таком движении скорость центра масс и соответственно кинетическая энергия молекул равна нулю и поэтому при их неупругом столкновении вся кинетическая энергия относительного движения переходит в энергию деформации образующегося комплекса, что обеспечивает наилучшие условия для протекания необратимого химического превращения. Напротив, те молекулы, которые движутся с одинаковой скоростью, в одном направлении, хотя и могут иметь большую кинетическую энергию в химической реакции не участвуют. [16]
Выполняется ли закон Аррениуса для сложной, реакции, если константа скорости выражается через константы отдельных-стадий: а) произведением; в) отношением; с) суммой или разностью. [17]
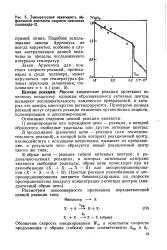 |
Температурная зависимость эффективной константы скорости окисления полиамида-12. [18] |
Подобное использование закона Аррениуса не всегда корректно, особенно в случае экстраполяции данной величины за пределы исследованного интервала температур. [19]
Отклонения от закона Аррениуса указывают на то, что кинетический закон реакции является более сложным и, возможно, включает несколько кинетических констант. Это, в частности, наблюдается для радиационно-химических реакций. [20]
В использовании закона Аррениуса имеется огромное затруднение, даже если речь идет об одной единственной, точно известной реакции: необходимо знать энергию активации. Если же речь идет о детали прибора или о целом приборе, например транзисторе, то в. Какой из них является решающим - дело иной раз сложного исследования, и формальный подход к решению вопроса может привести к неудачам. [21]
Рассмотрим применение закона Аррениуса для практических расчетов на конкретном примере. [22]
Отклонения от закона Аррениуса малы при низких температурах, когда критическая концентрация сильного антиоксиданта мала, отношение t 0 / fKp составляет не менее 102 и логарифм этого отношения слабо меняется при изменении гкр. [23]
Скорость следует закону Аррениуса лишь в определенных температурных интервалах: она проходит через максимум при некотором значении температур, лежащем в промежутке от 100 до 200, причем это значение растет с давлением этилена. [24]
Экспонента в законе Аррениуса изменяется от 10 - 318 до 10 - - 3 4, так что реакция ускоряется на 28 порядков. По сравнению с этим уже не так существенно, что дополнительное ускорение достигается за счет сжатия газа, которое увеличивает число соударений между молекулами. [25]
По сути дела закон Аррениуса для некоторых типов сложных реакций действует лишь в ограниченной области температур. В этом случае выражение для энергии активации состоит из многих членов, и в том числе нескольких энтальпий реакции. [26]
Таким образом, закон Аррениуса применим и к эффективным константам скорости многих сложных реакций, а наблюдаемая ( эффективная) энергия активации сложного процесса равна сумме энергий активации простых реакций, константы скорости которых стоят в числителе выражения эффективной константы, минус сумма энергий активации реакций, константы скорости которых стоят в знаменателе этого выражения. [27]
Таким образом, закон Аррениуса рассматривает долю частиц в данной системе, запас энергии которых достаточен для осуществления элементарной реакции. С повышением температуры средняя энергия исходной системы возрастает, увеличивается число частиц, обладающих необходимым избытком энергии, что и ведет к повышению скорости реакции. [28]
В то время закон Аррениуса, которому подчиняются скорости химических реакций, и лежащие в его основе предположения были настолько хорошо обоснованными, что не ощущалось ни-каксй необходимости следовать этой идее Нернста. [29]
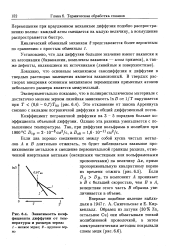 |
Зависимость коэффициента диффузии от температуры и размера зерна. [30] |
Страницы: 1 2 3 4