Закон - действующая масса
Cтраница 2
Закон действующих масс может быть сформулирован следующим образом: химическое равновесие устанавливается, когда произведение концентраций продуктов реакции, возведенных в степени, равные стехиометрическим коэффициентам, деленное на произведение концентраций реагентов, возведенных в соответствующие степени, становится постоянной величиной при определенных условиях. [16]
Закон действующих масс ( действия масс) ( 137) - уравнение, связывающее между собой активности ( концентрации) компонентов при достижении химического равновесия в системе при данной температуре. С помощью этого уравнения вводится понятие о константах равновесия, выраженных через различные единицы концентрации и коэффициенты активности. [17]
Закон действующих масс имеет вторую формулировку: для одной и той же температуры отношение произведений равновесных концентраций ( в степени их стехиометрических коэффициентов) веществ в правой и левой частях уравнения химического процесса представляет постоянную величину. [18]
Закон действующих масс в общем виде формулируется так: в данной обратимой химической реакции при установившемся равновесии отношение произведений концентраций полученных веществ к произведению - концентраций взятых веществ, возведенных в степени их стехиометрических коэффициентов, есть величина постоянная. [19]
Закон действующих масс формулируется в настоящее время следующим образом: скорость химических реакций при условии постоянной температуры прямо пропорциональна концентрациям реагирующих веществ. [20]
Закон действующих масс справедлив также и для реакций между растворенными веществами, если только раствор можно считать слабым. [21]
Закон действующих масс следует применять в том случае, если число агрегации мало или если его изменение заметно влияет на термодинамические функции. Если число агрегации велико, к мицеллообразованию следует подходить как к процессу разделения фаз. Если изменения энтропии и энтальпии в основном взаимно компенсируются из-за структурных особенностей воды, то теория точно предсказывает ККМ, подобно тому как теория регулярных растворов позволяет оценивать растворимость; соответствие же между теорией и экспериментом в отношении теплоты и энтропии растворения оказывается менее строгим. Теория должна объяснить такие характерные и хорошо известные факты, как зависимость ККМ 1) от длины углеводородной цепи и 2) от числа зарядов и концентрации противоионов. [22]
Закон действующих масс гласит: скорость химич еских реакций при постоянной температуре пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам перед формулами данных веществ в уравненииреакции. [23]
Закон действующих масс строго справедлив только для идеальных газов и разбавленных растворов. Однако этот закон применяют и для реальных газов, предполагая, что они подчиняются законам идеальных газов. [24]
Закон действующих масс можно применять и для гетерогенных реакций, которые имеют очень важное значение при горении и газификации твердых и жидких топлив. [25]
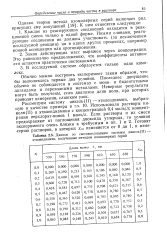 |
Данные по светопоглощению системы никель ( II - этилендиамин, полученные методом изомолярных серий. [26] |
Закон действующих масс выражен через концентрации. Это равнозначно предположению, что коэффициенты активности остаются практически постоянными. [27]
Закон действующих масс следует применять в том случае, если число агрегации мало или если его изменение заметно влияет на термодинамические функции. Если число агрегации велико, к мицеллообразованию следует подходить как к процессу разделения фаз. Если изменения энтропии и энтальпии в основном взаимно компенсируются из-за структурных особенностей воды, то теория точно предсказывает ККМ, подобно тому как теория регулярных растворов позволяет оценивать растворимость; соответствие же между теорией и экспериментом в отношении теплоты и энтропии растворения оказывается менее строгим. Теория должна объяснить такие характерные и хорошо известные факты, как зависимость ККМ 1) от длины углеводородной цепи и 2) от числа зарядов и концентрации противоионов. [28]
Закон действующих масс справедлив также и для реакций между растворенными веществами, если только раствор можно считать слабым. [29]
Закон действующих масс справедлив для равновесия ионной ассоциации и диссоциации ионных пар, так как, согласно выводу, природа сил, удерживающих частицы в недиссоции-рованном состоянии, не имеет особого значения. [30]
Страницы: 1 2 3 4