Электростатический подход
Cтраница 2
Хотя эта величина и имеет правильный порядок, она все же меньше длины простой С - С-связи, равной 1 54 А; таким образом, элементарный электростатический подход приводит к заниженному результату. [16]
Как уже отмечалось, водородная связь в ионе ( FHF) наиболее прочная. Электростатический подход позволяет высказать предположение, что прочность связи должна уменьшаться в ряду F, О, N, так как в этом ряду уменьшается сродство к электрону. Этот вывод действительно подтверждается экспериментально. С другой стороны, не было обнаружено возникновения водородных связей для других атомов, несмотря на то что по крайней мере для атомов С1 и S сродство к электрону имеет тот же порядок величины. Такое различие связано с тем, что электростатические взаимодействия вследствие гораздо больших ионных радиусов оказываются гораздо более слабыми, и, по-видимому, величин этих взаимодействий оказывается недостаточно для образования водородных связей. [17]
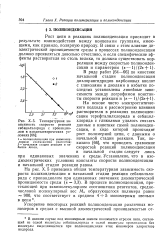 |
Температурная зависимость скорости реакции себацилхлорида с пропандиолом в изодиэлектрических условиях. [18] |
Рост цепи в реакциях поликонденсации присходит в результате взаимодействия между концевыми группами, имеющими, как правило, полярную природу. На основе чисто электростатического подхода к рассмотрению влияния - j - растворителя в реакциях поликонденсации терефталилхлорида и себацил-хлорида с гликолями удалось связать данные о кинетике самой поликонденсации, в ходе которой происходит рост полимерной цепи, с данными о начальной стадии реакции. [19]
Существуют два основных подхода к теории образования комплексных соединений. С точки зренчя электростатического подхода образование комплексного соединения происходит за счет кулоновского притяжения частиц и их взаимной поляризации. Например, при взаимодействии аммиака с НС1 ион водорода одновременно притягивается и ионом хлора, и азотом аммиака. Так как притяжение азотом выражено более сильно, образуется соль аммония с катионом NH4 и анионом С1 -, на которые она и распадется при растворении в воде. [20]
Существуют два основных подхода к теории образования комплексных соединений. С точки зрения электростатического подхода, ведущего свое начало от Косселя, образование комплексного соединения происходит за счет кулоновского притяжения частиц и их взаимной поляризации. Например, при взаимодействии аммиака с НС1 ион водорода одновременно притягивается и ионом хлора и азотом аммиака. Так как притяжение азотом выражено более сильно, образуется соль аммония с катионом NH и анионом С1 - -, на которые она и распадается при растворении ь воде. [21]
Существуют два основных подхода к теории образования комплексных соединений. С точки зрения электростатического подхода, ведущего свое начало от Косселя, образование комплексного соединения происходит за счет кулоновского притяжения частиц и их взаимной поляризации. Например, при взаимодействии аммиака с НС1 ион водорода одновременно притягивается и ионом хлора и азотом аммиака. Так как притяжение азотом выражено более сильно, образуется соль аммония с катионом NH и анионом С1 -, на которые она и распадается при растворении ь воде. [22]
Существуют два основных подхода к теории образования комплексных соединений. С точки зрения электростатического подхода образование комплексного соединения происходит за счет кулоновского притяжения частиц и их взаимной поляризации. Например, при взаимодействии аммиака с НС1 ион водорода одновременно притягивается и ионом хлора, и азотом аммиака. Так как притяжение азотом в сумме энергетически выгоднее, образуется соль аммония с катионом. NHJ и анионом С1 -, на которые она и распадается при растворении в воде. [23]
Как было отмечено Слэтсром [7], между цриближением Борна - Опнелгеймера и теоремой Гельмана - Фейнмаиа имеется следующая связь. Согласно же теореме Гельмана - Фейимана, электростатический подход ( в предположении, что известно правильное распределение электронов) используется для того, чтобы найти силу, действующую на ядра, и построить функцию Fn (), градиент которой, взятый со знаком минус, равен этой силе. [24]
Как было отмечено Слэтером [7], между приближением Берна - Оппенгеймера и теоремой Гельмана - Фейнмана имеется следующая связь. Согласно же теореме Гельмана - Фейнмана, электростатический подход ( в предположении, что известно правильное распределение электронов) используется для того, чтобы найти силу, действующую на ядра, и построить функцию Fn (), градиент которой, взятый со знаком минус, равен этой силе. [25]
Далее мы рассмотрим некоторые случаи, когда простой электростатический подход не позволяет объяснить влияние изменения диэлектрической проницаемости растворителя. В работе [13] были измерены скорости реакции м - С4Н91 - j - I -: t w - C4H9 I 1 при различных температурах в смесях метанола и ацетонитрила всех возможных соотношений. Хотя проницаемость меняется всего лишь в 1 2 раза, константа скорости бимолекулярной реакции изменяется в 50 раз и при том в направлении, обратном ожидаемому. Такие же результаты получены для реакции иодид-ионов с - С4Н9 Вг в водно-ацетоновых смесях. Вводя некоторые приближения, можно получить оценки констант равновесия, с помощью которых удается объяснить влияние изменения состава растворителя на скорость реакции. О - Н группы зависит от состава растворителя. Эту гипотезу можно логически распространить с учетом всех типов сольватированных ионов в растворе, от ( I, тоСН3ОН) - до ( I, тгСН3С1Ч) -, в том числе и частично сольвати-рованные ионы, окруженные молекулами обоих растворителей, например [ I, ( п - т) СН3ОН, mCH3CN ] -, где п - общее координационное число. [26]
Выбор триарилметил-катиона в качестве объекта для проверки электростатической теории структурных эффектов особенно удачен. Это показывает, что поведение триарил-метил-катионов адекватно описывается в большинстве случаев в рамках простого электростатического подхода. [27]
Обратим теперь внимание на усложнение характера мультипольного разложения при использовании электростатических соотношений для описания ван-дер-ваальсовых сил. Так, например, чтобы найти энергию лондоновского диполь-дипольного дисперсионного взаимодействия атомов (2.31) в рамках электростатического подхода, нельзя ограничиться дипольным приближением, а следует учесть и диполь-квадрупольное взаимодействие. Это связано с зависимостью (4.47) компонент квадрупольного момента от выбора начала координат. Если расстояние между атомами отсчитывается от их ядер, то положение каждого ядра служит и началом координат для соответствующего мультипольного разложения плотности заряда в атомах. В силу соотношения (4.47) на величине квадрупольного момента атома при сдвиге атомного ядра сказывается не только перемещение ядерного заряда, но и изменение начала координат для мультипольного разложения. [28]
В приведенных примерах применение теории кристаллического поля и теории поля лигандов приводит к одинаковым результатам. Однако, если лиганды способны образовывать я-связь ( 02, N0, СО, С2Н4, бензол и другие), чисто электростатический подход теории кристаллического поля не может объяснить свойства комплексов. При этом, в отличие от обычной донорно-акцепторной связи, происходит обратное смещение электронной плотности с центрального атома к лигандам. Такую связь часто называют дативной. Таким образом, для дативной связи нужны не пустые, а заполненные d - орбиты. [29]
Отсутствие в большинстве случаев количественных данных о ещед, а также данных об истинных радиусах ионов в растворе очень осложняет, а часто делает вообще невозможным строгий электростатический расчет энергетики сольватации. Вместе с тем в последние годы, благодаря нескольким наиболее скрупулезным расчетам Лейдлера и Глюкауфа, выполненным с учетом изменения диэлектрической проницаемости в зависимости от расстояния до иона, сделан очень важный шаг в области развития и усовершенствования электростатического подхода к описанию явлений сольватации. Результаты этих работ, а также работы Стокса [60] ( будут рассмотрены ниже) показывают, что электростатическая теория ионной сольватации может успешно конкурировать с более общими теориями, обсуждение которых здесь также будет проведено. Однако вначале следует остановиться на вопросе о радиусах сольватированных ионов. [30]
Страницы: 1 2 3