Закон - разведение
Cтраница 3
Константу диссоциации обычно измеряют посредством электропроводности, исходя из закона разведения. [31]
Зависимость между К и концентрацией может быть установлена с помощью закона разведения Оств лльда. [32]
Следует впрочем отметить, что даже с поправкой на коэфициент активности закон разведения не дает удовлетворительных результатов при его применении к сильным электролитам. [33]
Подставляя уравнение ( 1 30) в ( 1 9), получим выражение закона разведения через А. [34]
Диссоциацию и тем самым силу кислоты обычно выражают константой диссоциации k, выведенной из закона разведения, показывающего зависимость диссоциации слабой кислоты от ее концентрации. Эта зависимость вытекает из следующих рассуждений. [35]
Правомерность этой операции с особой наглядностью вырисовывается, если константу диссоциации вычислять по уровнению закона разведения. [36]
Диссоциацию и тем самым силу кислоты обычно выражают константой диссоциации k, выведенной из закона разведения, покачивающего зависимость диссоциации слабой кислоты от се концентрации. Эта зависимость вытекает из следующих рассуждений. [37]
Это выражение было получено Оствальдом ( 1892) в качестве первого примера применения законов равновесия к электролитической диссоциации. Называется оно законом разведения, а величина К - константой диссоциации. Из ( 201) ясно видно, что диссоциация должна расти с уменьшением концентрации. Этот факт нам уже знаком. Здесь он вытекает в качестве естественного следствия из законов равновесия. [38]
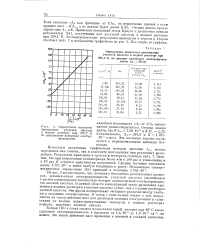 |
Определение константы Диссоциации уксусной кислоты в водном растворе при 298 1 К по результатам намерений электропроводности. [39] |
Из рис. 3 можно видеть, что, начиная с бесконечно разбавленных растворов, эквивалентная электропроводность уксусной кислоты уменьшается с ростом концентрации значительно быстрее эквивалентной электропроводности азотной кислоты. В данной области концентраций закон разведения применим к водным растворам уксусной кислоты лучше, чем к водным растворам азотной кислоты. Эти факты подчеркивают очевидное различие между слабыми и сильными электролитами. В связи с этим возник вопрос о том, выполняется ли закон действия масс для растворов сильных электролитов и существуют ли вообще недиссоциированные молекулы в водных растворах веществ, подобных азотной кислоте. [40]
Несовершенство этой теории обнаруживается в применении ее к сильным электролитам. Как было указано выше, закон разведения, выведенный из закона действия масс, не может быть распространен на сильные электролиты. [41]
Уравнения (1.2) и (1.3) были выведены В. Оствальдом и выражают сущность его закона разведения. [42]
Уравнения ( 52) и ( 53) были выведены В. Оствальдом и выражают сущность его закона разведения. [43]
Уравнения ( 1 - 2) и ( 1 - 3) были выведены В. Оствальдом и выражают сущность его закона разведения. [44]
Последнее уравнение было выведено В. Оствальдом, оно выражает сущность его закона разведения. [45]
Страницы: 1 2 3 4