Закон - гиббс
Cтраница 2
Правило фаз ( закон Гиббса) устанавливает количественную зависимость между числом степеней свободы, числом фаз и числом компонентов. Под числом степеней свободы системы понимают число независимых внешних ( температура, давление) и внутренних переменных ( концентрация), которые можно произвольно изменять без изменения числа фаз в системе. [16]
Таким образом, закон Гиббса - Дальтона качественно объясняет начальный ход кривой растворимости жидкости в газе. [17]
Правило фаз ( закон Гиббса) устанавливает количественную зависимость между числом степеней свободы, числом фаз и числом компонентов. Под числом степеней свободы системы понимают число независимых внешних ( температура, давление) и внутренних переменных ( концентрация), которые можно произвольно изменять без изменения числа фаз в системе. [18]
Таким образом, закон Гиббса - Дальтона качественно объясняет начальный ход кривой растворимости жидкости в газе. [19]
Для однозначной проверки закона Гиббса - Дальтона, чтобы избежать экстраполяции в область пересыщения, изучают растворимость в газе вещества не в чистом виде, а в растворе или в соединении. [20]
Поскольку в этом отношении закон Гиббса - Дальтона и закон Дальтона синонимичны, совершенно очевидно, что смесь идеальных газов, подчиняющихся закону Гиббса - Дальтона, удовлетворяет также закону Амага ( этот закон относится к парциальным объемам, определенным в разд. Для такой смеси идеальных газов также существует связь между парциальным давлением и мольной долей ( см. разд. Дальтона), когда парциальное давление определено через мембранное равновесие. Прямое доказательство этого приводится в следующем разделе. [21]
Если для смеси действителен закон Гиббса - Дальтона, то давление пара по левую сторону мембраны должно быть меньше, чем давление смеси по правую ее сторону. Поэтому уровень жидкости слева должен быть выше, чем справа, для того чтобы гидростатический напор уравновешивал указанную разность давлений двух столбиков пара. Пористая стенка отделяет левый столбик жидкости от соседнего с ней стфлбика чистого пара вещества /, имею - В щего доступ к свободной поверхности жидкости в верхней части сосуда. [22]
Далее излагается термодинамический вывод законов Гиббса - Коновалова и Вревского, данный в работах Ван-дер - Ваальса и Сторонкина. [23]
Если смесь газов подчиняется закону Гиббса - Дальтона, то она удовлетворяет также закону Дальтона для парциальных давлений ( разд. [24]
Если смесь газов подчиняется закону Гиббса - Дальтона, то молярная плотность Pi присутствующего в смеси компонента i равна молярной плотности pj этого компонента в чистом виде, находящегося в равновесии со смесью через полупроницаемую мембрану. [25]
Если смесь газов подчиняется закону Гиббса - Дальтона, то она удовлетворяет также закону Дальтона для парциальных давлений. [26]
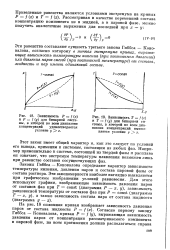
Эти соотношения отвечают третьему закону Гиббса - Коновалова. Из него следует, что в указанных условиях составы жидкой и газовой фаз изменяются симбатно. [27]
Эти равенства составляют сущность третьего закона Гиббса - Коновалова, согласно которому в точках экстремума кривых, выражающих зависимость температуры кипения ( при постоянном давлении) или давления паров смесей ( при постоянной температуре) от состава, жидкость и пар имеют одинаковый состав. [29]
Это неравенство является математической формулировкой второго закона Гиббса - Коновалова, согласно которому с увеличением концентрации любого компонента бинарной смеси в жидкой фазе возрастает его концентрация в паровой фазе. [30]
Страницы: 1 2 3 4