Закон - гиббс
Cтраница 3
Кричевский [4] показал, что на основе закона Гиббса - Дальтона можно дать качественное объяснение не только нисходящего участка кривой растворимости жидкости в газе, но и минимума растворимости. Однако расчеты, основанные на этом законе, не приводят к количественному совпадению с опытом. Кроме того, не находит объяснения тот участок экспериментальной кривой, который вогнут к оси давлений. [31]
Поведение системы в различных термодинамических условиях определяется законом Гиббса. [32]
Поведение системы в различных термодинамических условиях определяется законом Гиббса. [33]
Свойства систем в экстремальных точках описываются вторым законом Гиббса - Коновалова ( см. разд. [34]
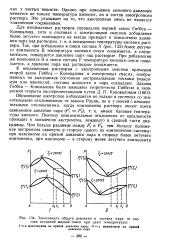 |
Зависимость общего давления и состава пара от состава исходной жидкой смеси при двух температурах. [35] |
К неидеальным растворам с азеотропными смесями применим второй закон Гиббса - Коновалова: в азеотропных смесях, изображенных на диаграммах состояния экстремальными точками ( максимум или минимум), составы жидкости и пара совпадают. [36]
Из вывода этих выражений следует, что третий закон Гиббса - Коновалова не имеет исключений. [37]
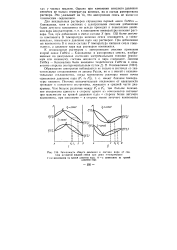 |
Зависимость общего давления и состава пара от состава исходной жидкой смеси при двух температурах. [38] |
К неидеальным растворам с азеотропными смесями применим второй закон Гиббса - Коновалова: в азеогропных смесях, изображенных на диаграммах состояния экстремальными точками ( максимум или минимум), составы жидкости и пара совпадают. [39]
Единственное, что можно с уверенностью утверждать о применимости закона Гиббса - Дальтона, - это то, что, подобно закону Дальтона, он, безусловно, выполняется для смесей идеальных газов. Поэтому можно считать, что этот закон применим к смесям реальных газов при очень низких давлениях. [40]
Уравнения (2.40) - (2.42) представляют собой математическую формулировку второго закона Гиббса - Коновалова. Из изложенного ясно, что все эти три уравнения взаимосвязаны. [41]
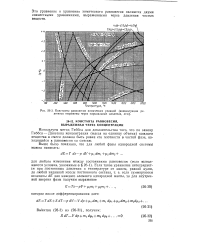 |
Константы равновесия химических реакций ( концентрации реагентов выражены через парциальные давления, атм.. [42] |
Используем метод Гиббса для доказательства того, что ло закону Гиббса - Дальтона концентрация ( масса на единицу объема) каждого вещества в смеси должна быть равна его плотности в чистой фазе, находящейся в равновесии со смесью. [43]
Мы нашли, что для идеальных газов, подчиняющихся закону Гиббса - Дальтона, уравнение равновесия ( 26 - 19) может быть приведено к соотношению ( 26 - 28), согласно которому произведение возведенных в соответствующие степени парциальных давлений газов постоянно. По аналогии можно ввести свойство, сопоставимое с давлением идеального газа, в функции которого уравнение равновесия может быть сходным образом преобразовано для других веществ. Для этого необходимо лишь определить новое свойство таким образом, чтобы величины М уравнения ( 26 - 19) являлись логарифмической функцией нового свойства. [44]
При вычислении растворимости чистого вещества в сжатом газе по закону Гиббса - Дальтона неизбежно приходится экстраполировать концентрацию пара вещества в область пересыщения. Эту экстраполяцию осуществляют по уравнению состояния вещества. Так, при вычислении растворимости эфира, хлороформа и бензола в сжатых газах экстраполяцию провели в предположении, что пары этих веществ в области пересыщения подчиняются законам идеальных газов. [45]
Страницы: 1 2 3 4