Кинетическая закономерность
Cтраница 3
Изученные кинетические закономерности в статических условиях были использованы для проведения синтеза в динамических условиях на ионообменной колонне. [31]
Подобные кинетические закономерности можно объяснить, полагая, что активные центры, ответственные за образование реакционноспособных анион-радикалов С2 - не отравляются продуктами реакции, которые перераспределяются с активных центров на соседние адсорбционные центры. [33]
Кинетические закономерности разрушения могут быть выявлены путем математического моделирования ударно-волновых процессов в разрушаемой среде. При согласии результатов моделирования с широким набором измеренных профилей скорости свободной поверхности можно с известной точностью утверждать, что использовавшееся в расчетах описание кинетики разрушения правильно отражает количественную сторону процесса. Такой подход применяется достаточно широко, однако, в силу неполноты теории, всегда имеются определенные затруднения в выборе кинетических уравнений и значений параметров, характеризующих конкретный материал. Для получения количественной информации о кинетических закономерностях разрушения непосредственно из анализа экспериментальных данных необходимо установить, как детали профиля скорости свободной поверхности связаны со скоростью разрушения и ее изменениями. [34]
 |
Схема установки. [35] |
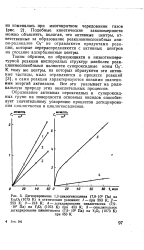
Кинетические закономерности синтеза были исследованы нами в опытах с изменяющейся по времени концентрацией Си ( II) - нестационарная система ( за скоростью реакции следили по изменению концентрации Си ( II)) и в условиях неизменной по времени концентрации Си ( II) - стационарная система. [36]
Кинетические закономерности ионизации некоторых металлов при повышенных температурах применительно к их электрохимической обработке. В кн.: Новое в электрохимической размерной обработке металлов. [37]
Кинетические закономерности разрушения могут быть выявлены путем математического моделирования ударно-волновых процессов в разрушаемой среде. При согласии результатов моделирования с широким набором измеренных профилей скорости свободной поверхности можно с известной точностью утверждать, что использовавшееся в расчетах описание кинетики разрушения правильно отражает количественную сторону процесса. Такой подход применяется достаточно широко, однако, в силу неполноты теории, всегда имеются определенные затруднения в выборе кинетических уравнений и значений параметров, характеризующих конкретный материал. Для получения количественной информации о кинетических закономерностях разрушения непосредственно из анализа экспериментальных данных необходимо установить, как детали профиля скорости свободной поверхности связаны со скоростью разрушения и ее изменениями. [38]
Кинетические закономерности полимеризационных процессов на металлорганических комплексных катализаторах согласуются с представлениями о составе каталитического комплекса и о роли каждого из компонентов комплекса. В каталитическом комплексе отсутствует разделение ионов. Этим обусловливается как бы постоянное переходное состояние в системе, через которое проходят молекулы мономера при образовании макроцепей. [39]
Кинетические закономерности цепных процессов рассматриваются в следующей главе. [40]
Кинетические закономерности цепного процесса существенно зависят от того, сколько активных центров образуется при элементарной реакции - одном звене цепи, что, определяется химическим механизмом. В некоторых процессах каждая реакция активного центра может приводить к регенерации только одного нового активного центра, если такая регенерация вообще происходит. В других процессах элементарная реакция дает не один, а два или более центров. Реакционные цепи второго типа называются разветвленными, первого - неразветвленными. [41]
Кинетические закономерности цепного процесса существенно зависят от того, сколько активных центров образуется при элементарной реакции - одном звене цепи, что определяется химическим механизмом. В некоторых процессах каждая реакция активного центра может приводить к регенерации только одного нового активного центра, если такая регенерация вообще происходит. В других процессах элементарная реакция дает не один, а два или более центров. Реакционные цепи второго типа называются разветвленными, первого - неразветвленными. [42]
Кинетические закономерности травления германия и соединений AII [ BV в кислых растворах хлорного железа находятся в соответствии с представлениями о строении этих соединений и природе химической связи в них. [43]
Кинетические закономерности электрохимических реакций при в 1 можно объяснить и в предположении, что и в этих условиях сохраняется механизм замедленного разряда. [44]
Кинетические закономерности цепных процессов рассматриваются в следующей главе. [45]
Страницы: 1 2 3 4