Ожидаемая закономерность
Cтраница 2
Ла-Мером, может быть применено и для газов. На рис. 25 представлены ожидаемые закономерности образования пузырьков. [16]
В обоих указанных выше случаях два одновременно хемосорбированных газа не взаимодействовали друг с другом. Если же они способны взаимодействовать между собой, то ожидаемые закономерности будут носить более сложный характер. Изучению этих закономерностей путем прямых хемосорбционных измерений посвящено сравнительно небольшое число работ. [17]
В обоих указанных выше случаях два одновременно хемосорбированных газа не взаимодействовали друг с другом. Если же они способны взаимодействовать между собой, то ожидаемые закономерности будут носить более сложный характер. Изучению этих закономерностей путем прямых хемосорбционных измерений посвящено сравнительно небольшое число работ. [18]
 |
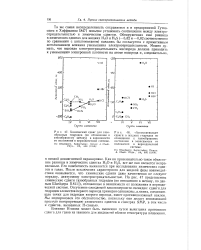
Дегидратация изопропилоеоео спирта над активированным катализатором. [19] |
С этой целью были проведены опыты с разведением паров спирта инертными газами С02, N2, Н2, не выявившие, однако, ожидаемой закономерности. Во всех случаях наблюдалась одна и та же особенность: разведение паров спирта газами резко увеличивало образование пропилена за счет эфира. Общий распад спирта при этом практически не менялся. [20]
Из рис. 5 видно, что при разных размерах цилиндров для одной и той же пробы получаются разные зависимости Р / ( п), причем некоторые из них ( 5 и 4 не имеют ожидаемой закономерности. Для разных размеров цилиндров и разных рабочих зазоров величины ц и TO оказываются разными. Это также видно из табл. 5, в которой приведены значения T. [21]
Необходимо отметить, что представленный ряд характеризует поведение металлов и их солей только в водных растворах и при комнатной температуре. Кроме того, нужно иметь в виду, что указанные в таблице стандартные электродные потенциалы учитывают особенности взаимодействия того или иного иона с молекулами растворителя. Это может нарушать некоторые ожидаемые закономерности в расположении металлов в электрохимическом ряду напряжений металлов. Например, электрохимический ряд напряжений металлов начинается литием, тогда как более активные в химическом отношении рубидий и калий находятся правее лития. Это связано с исключительно высокой энергией процесса гидратации ионов лития по сравнению с ионами других щелочных металлов. [22]
Необходимо отметить, что представленный ряд характеризует поведение металлов и их солей только в водных растворах и при комнатной температуре. Кроме того, нужно иметь в виду, что указанные в таблице 18 стандартные электродные потенциалы учитывают особенности взаимодействия того или иного иона с молекулами растворителя. Это может нарушать некоторые ожидаемые закономерности в расположении металлов в электрохимическом ряду напряжений металлов. Например, электрохимический ряд напряжений металлов начинается литием, тогда как более активные в химическом отношении рубидий и калий находятся правее лития. Это связано с исключительно высокой энергией процесса гидратации ионов лития по сравнению с ионами других щелочных металлов. [23]
Необходимо отметить, что представленный ряд характеризует поведение металлов и их солей только в водных растворах и при комнатной температуре. Кроме того, нужно иметь в виду, что указанные в таблице 18 стандартные электродные потенциалы учитывают особенности взаимодействия того или иного, иона с молекулами растворителя. Это может нарушать некоторые ожидаемые закономерности в расположении металлов в электрохимическом ряду напряжений металлов. Например, электрохимический ряд напряжений металлов начинается литием, тогда как более активные в химическом отношении рубидий и калий находятся правее лития. Это связано с исключительно высокой энергией процесса гидратации ионов лития по сравнению с ионами других щелочных металлов. [24]
Предполагаются и используются различные коэффициенты в виде соотношения отдельных углеводородов или их групп. Многие исследователи убеждены в том, что с помощью таких коэффициентов можно выявлять, фиксировать, описывать и классифицировать такого рода изменения по их генетическим особенностям. Однако все усилия завершаются пока выводами о наличии только тенденций к появлению ожидаемых закономерностей. [25]
При анализе возможного влияния адсорбированных поверхностно-активных веществ на кинетику электрохимических реакций и коррозию следует также учитывать характер коррозионной среды. Выведенные выше уравнения справедливы лишь для кислых сред. В нейтральных же и щелочных средах, в которых разряд водорода происходит из молекул воды, г н-потенциал, определяющий скорость этой реакции, будет иметь обратный знак и, следовательно, ожидаемые закономерности будут иными. [26]
 |
Диаграмма предельных напряжений стали Х18Н9Т, рассчитанных по данным обмера образца в зоне разрушения. [27] |
Характер деформированного состояния, а следовательно, и уровень предельных напряжений в этих случаях могут оказаться различными. Экспериментальные точки ( в относительных координатах), соответствующие предельным напряжениям, рассчитанным по результатам обмеров образцов в зоне разрушения, показаны на рис. 195, из которого видно, что пределы прочности при двухосном растяжении меньше, чем при одноосном, причем ожидаемых закономерностей их расположения не наблюдается. Учитывая, что, по данным работы [114], сталь Х18Н9Т имеет универсальную зависимость интенсивности напряжений от интенсивности деформаций, а также принимая во внимание, что инвариантность кривой о Ф ( et) подтверждена результатами испытаний близкой по химическому составу хромоникелевой стали Х18Н10Т ( см. гл. X), можно предположить, что образование шейки действительно приводит к изменению расчетных соотношений главных нормальных напряжений, которое может явиться причиной дополнительных погрешностей при построении предельных кривых разрушения. [28]
Как ни привлекательно такое объяснение разницы в химических сдвигах Н2О и H2S, все же оно является неправильным. Его ошибочность выявляется при исследовании химических сдвигов в газах. После исключения характерного для жидкой фазы взаимодействия оказывается, что химические сдвиги даже качественно не следуют порядку, диктуемому электроотрицательностью. На рис. 47 представлены химические сдвиги газообразных гидридов ( по отношению к метану, по данным Шнейдера [1811 ]), отложенные в зависимости от положения в периодической системе. Отсутствие ожидаемой закономерности очевидно: сдвиги для гидридов элементов первого периода примерно одинаковы, а линия, соединяющая точки для гидридов второго периода, имеет противоположный наклон. Мы подчеркиваем это обстоятельство, поскольку оно делает невозможной простую интерпретацию химических сдвигов в спектрах ЯМР, в том числе и сдвигов, вызванных Н - связыо. [30]
Страницы: 1 2 3