Законы - рауль
Cтраница 1
Законы Рауля и Генри, действительные лишь для идеальных растворов, во многих практических случаях выдерживаются настолько удовлетворительно, что на их основе можно проводить инженерные расчеты с вполне приемлемой точностью. Однако иногда использование этих законов приводит к недопустимым отклонениям, и поэтому законы Рауля и Генри рассматриваются лишь как законы идеального раствора, выдерживающиеся для реальных растворов с тем большей точностью, чем больше разбавлены растворы. Очень важно отметить, что для разбавленных растворов эти законы вполне точны, причем если закон Рауля применяют для растворителя, то закон Генри следует прилагать к растворенному компоненту и наоборот. В последующем изложении это положение будет иллюстрировано на примере расчета условий паро-жид-кого равновесия в системе компонентов с весьма слабой взаимной растворимостью. [1]
Законы Рауля не применимы к неидеальным жидким смесям, а к их парам неприменимы законы Дальтона. Достаточно точные результаты могут быть получены при использовании этих законов только в случае незначительных концентраций компонента в смеси. [2]
Законы Рауля и Генри, как это вытекает из условий их вывода, являются предельными законами для бесконечно разбавленных растворов. Области концентраций, в которых возможно практическое применение этих законов, определяются свойствами рассматриваемой системы и требованиями, предъявляемыми к точности расчетов. [3]
Законы Рауля - уравнение (1.48) и Дальтона - (1.51) могут применяться лишь к практически идеальным в жидкой фазе растворам, паровая фаза которых подчиняется уравнению состояния идеальных газов. [4]
Законы Рауля и Генри в общем случае описывают поведение любых бесконечно pa i-бавленных растворов. [5]
Законы Рауля, так же как и законы осмотического давления Вант-Гоффа, действительны только для разбавленных ( слабых) растворов. [6]
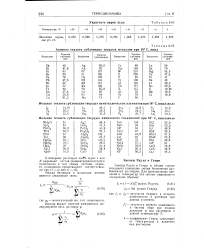 |
Атомная теплота сублимации твердых металлов при 18 С, ккал. [7] |
Законы Рауля и Генри в общем случае описывают поведение любых бесконечно разбавленных растворов. [8]
Законы Рауля будут справедливы по-прежнему только для разбавленных растворов. [9]
 |
Прибор для определения степени диссоциации электролита криоскопическим методом. [10] |
Законы Рауля и Вант-Гоффа [ см. уравнения (8.3), (8.4) и (8.19) ] справедливы только для разбавленных растворов неэлектролитов. Растворы электролитов обнаруживают значительные отклонения от этих законов вследствие электролитической диссоциации. Как было показано, это дает возможность опытным путем определять поправочный коэффициент i и по нему рассчитывать степень диссоциации электролита. [11]
Законы Рауля используются для определения молярной массы неэлектролитов. [12]
Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного рода взаимодействиями между частицами растворенного вещества, а также растворенного вещества и растворителя. Учет влияния на свойства растворов этих взаимодействий очень сложен и не всегда практически осуществим. Поэтому было предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящих в них концентраций компонентов ввести активности. [13]
Законы Рауля, Вант-Гоффа и Нернста-Шилова, осмотическое давление, коэффициент распределения. [14]
Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного рода взаимодействиями между частицами растворенного вещества, а также растворенного вещества и растворителя. Учет влияния на свойства растворов этих взаимодействий очень сложен и не всегда практически осуществим. Поэтому было предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящей в них концентрации компонентов ввести активность. [15]
Страницы: 1 2 3 4