Законы - рауль
Cтраница 3
Первый и второй законы Рауля и закон Вант-Гоффа, выраженные уравнениями (8.7) (17.7) (18.7) и (20.7), показывают, каким путем можно определить молекулярный вес растворенного вещества. Проблема определения молекулярного веса является важнейшей проблемой химии. [31]
Из уравнений, выражающих законы Рауля и Дальтона, видно, что при п о с т о. [32]
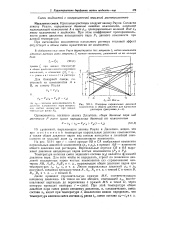 |
Изотермы парциальных давлений. [33] |
Из уравнений, выражающих законы Рауля и Дальтона, видно, что при постоянной температуре парциальные давления компонентов, а также общее давление паров над смесью находятся в линейной зависимости от мольной доли ХА низкокипящего компонента. [34]
Из уравнений, выражающих законы Рауля и Дальтона, видно, что-при постоянной температуре парциальные давления компонентов, а также общее давление паров над смесью находятся в линейной зависимости от мольной доли ХА низкокипящего компонента. [35]
Для идеальных растворов справедливы законы Рауля и Генри, характеризующие парциальные давления насыщенного пара растворителя pt и растворенного вещества - р над раствором. [36]
Для идеальных смесей применимы законы Рауля и Дальтона, которые устанавливают связь между парциальным давлением компонента в паровой фазе и его содержанием в жидкости. [37]
Такие растворы, где законы Рауля и Генри прило-жимы при любом соотношении жидкостей, принято называть идеальными растворами. [38]
Для ряда реальных растворов законы Рауля и Генри дают вполне приемлемые для целей практического расчета результаты, хотя в иных случаях погрешность может оказаться недопустимо высокой. [39]
Следует подчеркнуть, что законы Рауля и Вант-Гоффа см. уравнения ( 33), ( 34) и ( 46)) справедливы только для разбавленных растворов неэлектролитов. Растворы электролитов обнаруживают значительные отклонения от этих законов вследствие электролитической диссоциации. Как было показано, это дает возможность опытным путем определять поправочный коэффициент i и по нему рассчитывать степень диссоциации электролита. [40]
В общем случае реальных растворов законы Рауля и Генри не действуют. [41]
Для каких растворов точно выполняются законы Рауля и Вант-Гоффа. [42]
Для определения условий газожидкостного равновесия используются законы Рауля и Дальтона, согласно которым константа равновесия характеризуется отношением молярных долей компонента в равновесных газовой и жидкой фазах или отношением парциального давления компонента к общему давлению системы. Отсюда следует, что с увеличением давления системы уменьшается молярная концентрация компонента в газовой фазе при одновременном ее возрастании в жидкой. Температура влияет на процесс в обратном направлении: с повышением температуры растет давление паров ( а следовательно, и молярная концентрация компонента) в газовой фазе при соответственном ее уменьшении в жидкой фазе. [43]
Для определения условий газожидкостного равновесия используются законы Рауля и Дальтона ( см. гл. Отсюда следует, что с увеличением давления системы уменьшается молярная концентрация компонента в газовой фазе при одновременном ее возрастании в жидкой. Температура влияет на процесс в обратном направлении: с повышением температуры растет давление паров ( следовательно, и молярная концентрация компонента) в газовой фазе при соответственном ее уменьшении в жидкой фазе. [44]
Для определения условий газожидкостного равновесия используются законы Рауля и Дальтона, согласно которым константа равновесия характеризуется отношением молярных долей компонента в равновесных газовой и жидкой фазах или отношением парциального давления компонента к общему давлению системы. Отсюда следует, что с увеличением давления системы уменьшается молярная концентрация компонента в газовой фазе при одновременном ее возрастании в жидкой. Температура влияет на процесс в обратном направлении: с повышением температуры растет давление паров ( а следовательно, и молярная концентрация компонентов) в газовой фазе при соответственном ее уменьшении в жидкой фазе. [45]
Страницы: 1 2 3 4