Понижение - растворимость - осадок
Cтраница 1
Понижение растворимости осадка в кислотах происходит в результате дегидратации и перехода гидроокиси из аморфной модификации в скрыто кристаллическую. Такое явление носит название старения осадка. Способностью к старению отличается не только А1 ( ОгЬ -, но и ряд гидроокисей других металлов. [1]
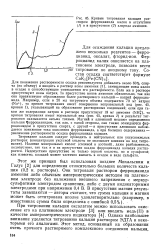 |
Кривые титрования кальция раствором ферроцианида калия в отсутствие ( 1 и в присутствии ( 2 хлорида аммония. [2] |
Для понижения растворимости осадка рекомендуется добавлять около 60 % спирта ( по объему) и вводить в раствор ионы аммония [1], замещающие ионы калия в осадке и способствующие уменьшению его растворимости. Если же в растворе присутствуют ионы натрия, то присутствие ионов аммония обязательно, так как они препятствуют образованию более растворимого кальций - натрий ферроцианида. Например, если в 20 мл титруемого объема содержится 70 мг натрия ( Na), то кривая титрования имеет совершенно неправильный ход ( рис. 45, кривая 1), указывающий на образование растворимых соединений; если при таком же содержании натрия в растворе присутствует 18 мг аммония ( NHJ), то кривая титрования имеет нормальный вид ( рис. 45, кривая 2) и результат титрования оказывается весьма точным. Магний и алюминий мешают определению кальция 1рерроцианидом, так как, с одной стороны, они также осаждаются фер-роцианидом в присутствии спирта, с другой - в присутствии алюминия наблюдается понижение тока окисления ферроцианида, а при больших содержаниях - увеличение растворимости осадка ферроцианида кальция. [3]
Для понижения растворимости осадка MgNH4P04 к раствору приливают в один прием еще 10 мл концентрированного аммиака, хорошо перемешивают, покрывают часовым стеклом и оставляют стоять на 12 часов, а при очень незначительном осадке-на 24 часа. [4]
Иногда добавление осадителя вначале действительно вызывает понижение растворимости осадка, а затем приводит к повышению растворимости. При дальнейшем же увеличении концентрации NaCl растворимость AgCl значительно повышается. [5]
При дальнейшем увеличении рН раствора идет сначала понижение растворимости осадка А1 ( ОН) 3, а затем при рН - 8 [ 8, с. Следовательно, в образующемся буферном растворе, рН которого 8 - 10, А1 ( ОН) 3 может не выпадать в осадок. Для снижения рН до 5 - 6, оптимального для осаждения А1 ( ОН) 3, раствор следует кипятить до удаления аммиака. [6]
При выполнении реакций осаждения небольшой избыток реактива прибавляют не только для понижения растворимости осадка, но и для предупреждения образования коллоида. Большого избытка реактива следует избегать по двум причинам: 1) он увеличивает растворимость осадка вследствие образования комплексных ионов; 2) избыток реактива пептизирует осадок, л репятствуя полноте осаждения. [7]
Затем следует обязательное промывание осадка водой, к которой прибавлено небольшое количество раствора осадителя для понижения растворимости осадка. Промывную жидкость наливают в пробирку с осадком, взбалтывают стеклянной палочкой, центрифугируют и опять пипеткой отделяют центри-фугат от осадка. Кристаллические осадки достаточно промыть дважды, аморфные промывают многократно. [8]
 |
Водяная баня с приспособлением для поддержания постоянного уровня воды. [9] |
Затем следует обязательное промывание осадка водой, к которой прибавлено небольшое количество раствора осадителя для понижения растворимости осадка. Промывную жидкость наливают в пробирку с осадком, взбалтывают стеклянной палочкой, центрифугируют и опять пипеткой отделяют центрифугат от осадка. Кристаллические осадки достаточно промыть дважды, аморфные промывают многократно. [10]
Осаждение фосфориомолибденовокислого аммония проводят из слабокислого раствора, в который добавляют 5 - 10 % азотнокислого аммония для понижения растворимости осадка. Слишком высокая концентрация азотной кислоты может привести к разрушению комплексного соединения, а пониженное содержание может привести к загрязнению осадка молибденовой кислотой, которая плохо растворима в воде и в разбавленных кислотах. Оптимальной температурой для осаждения является 60 - 70 С. Выпадение осадка задерживается при наличии в растворе больших количеств сульфатов, солямой и фтористоводородной кислот. Мешают определению мышьяковая и кремниевая кислоты, так как они также дают комплексные соединения с молибда-том аммония. [11]
Титрование проводится в нейтральном по фенолфталеину растворе, содержащем роданид аммония в качестве индикатора, хлорид натрия и спирт для понижения растворимости осадка и эфир, который делает точку эквивалентности более отчетливой. [12]
Для амперометрического определения использована также малая растворимость оксалата кальция: например, при титровании3 кальция на хлоридно-аммиачном фоне в присутствии спирта ( для понижения растворимости осадка) и ионов меди в качестве индикатора. Однако проще и удобнее титровать 4 кальций оксалатом по току окисления последнего: оказалось, что на фоне 0 1 М нитрата калия оксалат-ион дает хорошо выраженную полярографическую волну на платиновом электроде. Для титрования рекомендуется потенциал между 0 9 и 1 0 в ( Нас. [13]
Для амперометрического определения использована также малая растворимость оксалата кальция: например, при титровании кальция на хлоридно-аммиачном фоне в присутствии спирта ( для понижения растворимости осадка) и ионов меди в качестве индикатора. Однако проще и удобнее титровать 4 кальций оксалатом по току окисления последнего: оказалось, что на фоне 0 1 М нитрата калия оксалат-ион дает хорошо выраженную полярографическую волну на платиновом электроде. Для титрования рекомендуется потенциал между 0 9 и 1 0 в ( Нас. [14]
На ртутном капельном электроде при - 0 8 в ( донная ртуть) восстанавливается только медь, следовательно, кривая титрования имеет форму а; рН должен-быть 6 1 - 6 7, этанол добавляется для понижения растворимости осадка. Титруют в присутствии желатины. Через раствор пропускают быстрый ток азота, чем достигается не только удаление растворенного кислорода, но и коагуляция грязно-зеленого осадка селенита меди. [15]
Страницы: 1 2 3