Понижение - теплоемкость
Cтраница 1
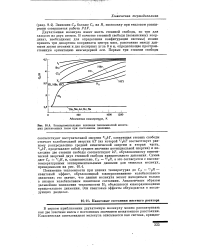 |
Экспериментальные значения теплоемкостей некоторых двухатомных газов при постоянном давлении. [1] |
Понижение теплоемкости при низких температурах до СР 7 / 2Д - квантовый эффект, обусловленный замораживанием колебательного движения; это значит, что данная молекула может находиться только в низшем колебательном квантовом состоянии. Аналогичным образом дальнейшее понижение теплоемкости Н2 объясняется замораживанием вращательного движения. Эти квантовые эффекты обсуждаются в последующих разделах. [2]
При более высоких температурах понижение теплоемкости расплавленных металлов замедляется. [3]
Отказываясь распространить высказанное представление о причине понижения теплоемкости на растворы всех солей - мы тем не менее должны сделать вывод, относящийся ко всем случаям изучения теплоемкости растворов. Настоящее исследование указывает на то, что понижение теплоемкости не только зависит от уменьшения концентрации, но также от понижения температуры. Отсюда понятно, почему сравнение теплоемкости растворов различных солей в зависимости от одной концентрации не привело к каким-либо заключениям. При изучении теплоемкости растворов необходимо иметь в виду, что понижение теплоемкости настолько же является функцией концентрации, как и температуры. [4]
В 1875 - 1879 гг. Бертло [29] связывал понижение теплоемкости при растворении электролитов в воде с образованием гидратов и пытался объяснить это явление тем. Он приписывал гидратной воде теплоемкость льда, отождествляя ее с кристаллизационной водой. Ничем тогда не обоснованное предположение позднее, в различных модификациях, с постепенным усложнением и вкладыванием различного смысла в понятие образование гидрата, фигурирует во многих гипотетических построениях, но явление по мере накопления наблюдений оказывается все более сложным. [5]
В 1875 - 1879 гг. Бертло [29] связывал понижение теплоемкости при растворении электролитов в воде с образованием гидратов и пытался объяснить это явление тем, что теплоемкость гидратной воды меньше, чем свободной. Он приписывал гидратной воде теплоемкость льда, отождествляя ее с кристаллизационной водой. Ничем тогда не обоснованное предположение позднее, в различных модификациях, с постепенным усложнением и вкладыванием различного смысла в понятие образование гидрата, фигурирует во многих гипотетических построениях, но явление по мере накопления наблюдений оказывается все более сложным. [6]
В 1898 г. Д. П. Коновалов [30] и Е. В. Бирон [31] сопоставляют понижение теплоемкости при растворении электролитов в воде со способностью растворяемого вещества проводить электрический ток. [7]
В 1898 г. Д. П. Коновалов [399] и Е. В. Бирон [400] сопоставляют понижение теплоемкости при растворении электролитов в воде со способностью растворяемого вещества проводить электрический ток. [8]
В 1898 г. Д. П. Коновалов [30] и Е. В. Бирон [31] сопоставляют понижение теплоемкости при растворении электролитов в воде со способностью растворяемого вещества проводить электрический ток. [9]
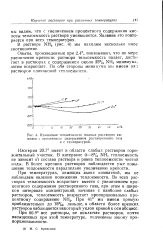 |
Изменение теплоемкости водных растворов аммиака с процентным содержанием растворенного газа и с температурой. [10] |
При температурах, лежащих выше комнатной, мы не наблюдаем явления понижения теплоемкости. При 41 мы имеем прямую приблизительно до 15 / 0) дальше, в области более крепких растворов наблюдается некоторый уклон кривой к оси абсцисс. [11]
При дальнейшем повышении температуры происходит интенсивный рост наночастиц Си и обусловленное этим понижение теплоемкости до значений, соответствующих массивной меди. Согласно [115] теплоемкость наночастиц никеля Ni диаметром 22 нм примерно в 2 раза больше теплоемкости массивного никеля при 300 - 800 К. На зависимости С ( Т) n - Ni наблюдаются слабый размытый экзотермический эффект при 380 - 480 К, связанный с собирательной кристаллизацией частиц никеля, и большой эндотермический пик с максимумом при 560 К, обусловленный магнитным фазовым переходом. В массивном никеле слабый эндотермический пик, соответствующий магнитному превращению, наблюдался при 630 К. [12]
Интересной попыткой решения проблемы является работа Эверет-та и Коульсона [43], в которой авторы стремятся объяснить понижение теплоемкости растворителя в растворе потерей его молекулами некоторых вращательных степеней свободы в результате взаимодействий с ионами и вмерзания в гидратные оболочки. Однако вычисления приводят к выводу, что этим может быть объяснена только часть фактического понижения теплоемкости. В пессимистических и раслывчатых выводах высказывается мысль, что для расшифровки изменений теплоемкости необходимо учитывать также иные, более специфические факторы, связанные с взаимодействием растворитель - растворенное вещество. [13]
Интересной попыткой решения проблемы является работа Эве-ретта и Коульсона [406], в которой авторы стремятся объяснить понижение теплоемкости растворителя в растворе потерей его молекулами некоторых вращательных степеней свободы в результате взаимодействий с ионами и вмерзания в гидратные оболочки. [14]
Интересной попыткой решения проблемы является работа Эверет-та и Коульсона [43], в которой авторы стремятся объяснить понижение теплоемкости растворителя в растворе потерей его молекулами некоторых вращательных степеней свободы в результате взаимодействий с ионами и вмерзания в гидратные оболочки. Однако вычисления приводят к выводу, что этим может быть объяснена только часть фактического понижения теплоемкости. В пессимистических и раслывчатых выводах высказывается мысль, что для расшифровки изменений теплоемкости необходимо учитывать также иные, более специфические факторы, связанные с взаимодействием растворитель - растворенное вещество. [15]
Страницы: 1 2 3