Понижение - теплоемкость
Cтраница 2
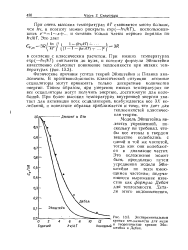 |
Экспериментальная [ 2 крнпап теплоемкости для мели. [16] |
При низких температурах ехр ( - h - jkT) снижается до нуля, и поэтому формула Эйнштейна качественно объясняет понижение теплоемкости при низких температурах ( рас. [17]
С 1885 по 1907 гг. Тамман [17] в Юрьевском университете проводил цикл работ по изучению теплоемкостей и положил начало длительному увлечению представлением о сильном сжатии воды в окружении ионов как основной причине понижения теплоемкости при растворении электролита в воде. Идеи Таммана, в общем продуктивные для рассмотрения влияния внутреннего давления ( Binnendruck) на свойства растворов, едва ли могут быть плодотворными сейчас при разработке теории теплоемкостей. При сравнении с современными, значительно более точными данными, отклонения результатов вычислений Таммана от экспериментальных значений в большинстве случаев оказываются не меньше, чем при расчетах по простому правилу смешения. В области же концентрированных растворов применение уравнений Таммана систематически приводит к результатам худшим, чем правило смешения. Кроме того, его теория оказывается совершенно бессильной при попытках объяснения изменений теплоем кости с концентрацией и температурой. [18]
С 1885 по 1907 гг. Тамман [34] в Юрьевском университете проводил цикл работ по изучению теплоемкостей и положил начало длительному увлечению представлением о сильном сжатии воды в окружении ионов как основной причине понижения теплоемкости при растворении электролита в воде. Идеи Таммана, в общем продуктивные для рассмотрения влияния внутреннего давления ( Binnen-druck) на свойства растворов, едва ли могут быть плодотворными сейчас при разработке теории теплоемкостей. При сравнении с современными, значительно более точными данными, отклонения результатов вычислений Таммана от экспериментальных значений в большинстве случаев оказываются не меньше, чем при расчетах по простому правилу смешения. В области же концентрированных растворов применение уравнений Таммана систематически приводит к результатам худшим, чем правило смешения. Кроме того, его теория оказывается совершенно бессильной при попытках объяснения изменений теплоемкости с концентрацией и температурой. [19]
С 1885 по 1907 гг. Тамман [34] в Юрьевском университете проводил цикл работ по изучению теплоемкостей и положил начало длительному увлечению представлением о сильном сжатии водь: в окружении ионов как основной причине понижения теплоемкости при растворении электролита в воде. Идеи Таммана, в общем продуктивные для рассмотрения влияния внутреннего давления ( Binnen-druck) на свойства растворов, едва ли могут быть плодотворными сейчас при разработке теории теплоемкостей. При сравнении с современными, значительно более точными данными, отклонения результатов вычислений Таммана от экспериментальных значений в большинстве случаев оказываются не меньше, чем при расчетах по простому правилу смешения. В области же концентрированных растворов применение уравнений Таммана систематически приводит к результатам худшим, чем правило смешения. Кроме того, его теория оказывается совершенно бессильной при попытках объяснения изменений теплоемкости с концентрацией и температурой. [20]
Отказываясь распространить высказанное представление о причине понижения теплоемкости на растворы всех солей - мы тем не менее должны сделать вывод, относящийся ко всем случаям изучения теплоемкости растворов. Настоящее исследование указывает на то, что понижение теплоемкости не только зависит от уменьшения концентрации, но также от понижения температуры. Отсюда понятно, почему сравнение теплоемкости растворов различных солей в зависимости от одной концентрации не привело к каким-либо заключениям. При изучении теплоемкости растворов необходимо иметь в виду, что понижение теплоемкости настолько же является функцией концентрации, как и температуры. [21]
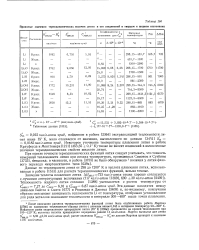 |
Принятые значения термодинамических величин лития и его соединений в твердом и жидком состояниях. [22] |
Теплоемкость жидкого лития согласно [1389] уменьшается с ростом температуры от Ср45з 7 7 27 до Ср6об 6 91 и Ср120о 6 87 кал / г-атом - град. Эти данные находятся между данными Бейтса и Смита [677] и Редмонда и Джонса [3409] и, по-видимому, наилучшим образом описывают зависимость теплоемкости Li от температуры, отображая установленное для ряда металлов понижение теплоемкости в интервале 300 - 400 выше точки плавления. [23]
Совпадение его результатов с экспериментом в случаях хлористого аммония и нитрата аммония не вполне удовлетворительно. В этой связи интересно отметить, что переход в кривой теплоемкости, сопровождающий явление перехода порядок-беспорядок в сплавах, так же как и переход в кривых теплоемкости веществ, подобных хлористому аммонию, являются типичными А-точками [73], для которых характерно понижение теплоемкости обратно до нормального значения выше точки перехода. В случае высокополимерных веществ, так же как и в случае органических стекол, изучавшихся Парксом с сотрудниками, возрастание теплоемкости при Тт сохраняется во всей области высоких температур. В первом случае X -точка, очевидно, связана с определенными процессами ( переход решетки в состояние беспорядка, переход ионоз или молекул в состояние вращения), которые, будучи завершены, не требуют более приращения энергии. Это достаточно хорошо видно в случае бромистого водорода, который имеет три отчетливо заметных перехода второго рода ( л - точки) в близкой последовательности и которые Паулинг [90] приписывает прекращению вращения последовательно около трех кристаллографических осей. [24]
При понижении температуры теплоемкости всех веществ уменьшаются, так как при этом ослабляются колебательные движения атомов в кристаллической решетке. Следовательно, степень порядка в системе возрастает и энтропия понижается. Рассмотрим, каков предел понижения теплоемкости, роста степени порядка и уменьшения энтропии и при какой температуре этот предел достигается. [25]
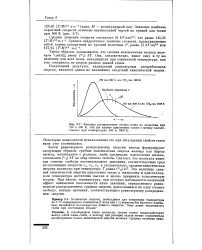 |
Функция распределения атомов гелия по скоростям при 100 и 400 К. Эти две кривые приложимы также к метану соответственно при температурах 400 и 1600 К. [26] |
Закон равномерного распределения энергии иногда формулируют следующим образом: средняя, кинетическая энергия молекул или других частиц, находящихся в условиях, когда применима классическая теория, составляет ( V2) kT на одну степень свободы. Эта величина средней кинетической энергии приложима также к жидкостям и кристаллам, если температура достаточно высока и можно применять классическую теорию. При низких температурах, при которых наблюдается квантовый эффект понижения теплоемкости ниже значения, определяемого равномерным распределением, средняя энергия, приходящаяся на одну степень свободы, меньше значения, соответствующего равномерному распределению энергии. [27]
При понижении температуры теплоемкости всех веществ понижаются, так как при этом замедляется движение атомов в кристаллической решетке. А это значит, что в системе возрастает порядок и энтропия системы понижается. Спрашивается, каков же предел понижения теплоемкости, роста порядка и уменьшения энтропии. При какой температуре этот предел достигается. [28]
Эффективная теплоемкость; при 20 С составляет 0 505 кал / г град, закономерно увеличиваясь с нагревом, она достигает 0 622 кал / г-град при 350 С. Дальнейший нагрев приводит к резкому увеличению эффективной теплоемкости, вызванному эндотермическими реакциями коксования, сопровождающимися обильным выделением летучих веществ. При температуре 475 С эффективная теплоемкость достигает максимального значения 5 09 кал / гX град. Дальнейший нагрев продукта приводит к понижению теплоемкости, и при 500 С эффективная теплоемкость составляет 4 201 кал / г, град. Истинная теплоемкость гудрона начиная с температуры 350 С незначительно уменьшается от 0 622 до 0 470 кал / г, град при 500 С, что следует объяснить обогащением нефтяного сырья углеродом. [29]
Эффективная теплоемкость при 20 С составляет 0 505 кал / г град, закономерно увеличиваясь с нагревом, она достигает 0 622 кал / г-град при 350 С. Дальнейший нагрев приводит к резкому увеличению эффективной теплоемкости, вызванному эндотермическими реакциями коксования, сопровождающимися обильным выделением летучих веществ. При температуре 475 С эффективная теплоемкость достигает максимального значения 5 09 кал / гХ град. Дальнейший нагрев продукта приводит к понижению теплоемкости, и при 500 С эффективная теплоемкость составляет 4 201 кал / г, град. Истинная теплоемкость гудрона начиная с температуры 350 С незначительно уменьшается от 0 622 до 0 470 кал / г, град при 500 С, что следует объяснить обогащением, нефтяного сырья углеродом. [30]
Страницы: 1 2 3