Понятие - химический потенциал
Cтраница 2
Из этого примера видно также, что понятие химического потенциала, являясь по существу энергетическим ( ц; dG / dni), применимо не только к химическим реакциям, но и к другим процессам. [16]
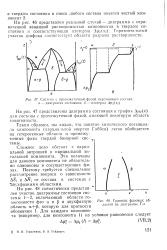 |
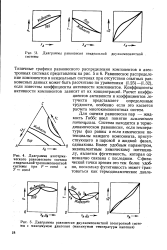
Система с промежуточной фазой переменного состава. а - диаграмма состояния. б - изотерма ДЦ2 ( 2. [17] |
Таким образом, мы видим, что понятие химического потенциала компонента ( парциальной энергии Гнббса) легко обобщается на гетерогенные области и промежуточные фазы твердой бинарной сие-темы. [18]
Свойства гелиевых пленок удобно обсуждать, пользуясь понятием химического потенциала. [19]
Для оценки равновесия пар - жидкость Гиббс ввел понятие химического потенциала. Система находится в термодинамическом равновесии, если температуры фаз равны и если химические потенциалы каждого компонента, присутствующего в паровой и жидкой фазах, одинаковы. Более удобным параметром, эквивалентным химическому потенциалу, является фугитивность, которая однозначно связана с последним. [21]
Из этого примера мы видим также, что понятие химического потенциала, являясь по существу энергетическим ( ц dGjdrii), применимо не только к химическим реакциям, но и к другим процессам. [22]
Для рассмотрения химического равновесия в смеси идеальных газов пользуются понятием химического потенциала. Химическим потенциалом компонента [ ц называется частная производная термодинамического потенциала Z ( а также свободной энергии F, теплосодержания Н и внутренней энергии U) по числу молей компонента щ при постоянстве прочих независимых переменных. [23]
Для рассмотрения химического равновесия в смеси идеальных газов пользуются понятием химического потенциала. Химическим потенциалом компонента ( ц называется частная производная термодинамического потенциала Z ( а также свободной энергии F, теплосодержания Н и внутренней энергии U) по числу молей компонента HI при постоянстве прочих независимых переменных. [24]
Для рассмотрения химического равновесия в смеси идеальных газов пользуются понятием химического потенциала. Химическим потенциалом компонента [ i - называется частная производная термодинамического потенциала ( свободной энергии), а также теплосодержания Н и внутренней энергии U по числу молей компонента HI при постоянстве прочих независимых переменных. [25]
В дальнейшем будет использовано еще одно часто употребляемое в термодинамике понятие химического потенциала. [26]
Для систем, число компонентов в которых больше Одного, вводится понятие химического потенциала компонента. [27]
Для того чтобы обобщить рассмотренный выше вывод закона действующих масс на любую реакцию, надо более подробно исследовать понятие химического потенциала компонента в смешанной фазе. Если имеется лишь один идеальный газ, то вместо парциальных давлений в уравнение подставляется общее давление в системе. [28]
Важную роль при анализе различных процессов, происходящих в термодинамических системах ( в частности, при анализе фазовых переходов), играет понятие химического потенциала. [29]
Здесь Гиббс, исходя из первого и второго законов термодинамики, дает наиболее общую формулировку условий равновесия для гетерогенных систем и впервые вводит понятие химического потенциала. [30]
Страницы: 1 2 3