Понятие - энергия - активация
Cтраница 1
Понятие энергии активации определяется существованием потенциальных энергетических барьеров, с преодолением которых связано любое химическое превращение. [1]
Понятие энергии активации определяется существованием потенциальных барьеров, с преодолением которых связано любое химическое превращение. Каждой определенной конфигурации атомов реагирующих молекул соответствует некоторое значение потенциальной энергии системы. [2]
Понятие энергии активации, как параметра, характеризующего скорость химической реакции, было введено Аррениусом [1] для объяснения влияния температуры на скорость инверсии сахара. [3]
Понятие энергии активаций, введенное еще С. Аррениусом и ВантТоффом, позволяет нам свести все многообразие молекул различных веществ к некоторой обобщенной энергетической характеристике. [4]
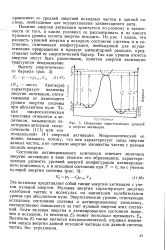 |
Изменения энергетических уровней и энергия активации. [5] |
Понятие энергии активации трактуется по-разному в зависимости от того, в каких условиях ее рассматривать и из какого нулевого уровня отсчета энергии исходить. Из рис. 1 видно, что разность уровней энергии в исходном состоянии системы и в состоянии, отвечающем конфигурации, необходимой для осуществления превращения в продукт элементарной реакции, представляет собой ее энергетический барьер. Так как уровни отсчета энергии могут быть различными, понятия энергии активации трактуются неоднозначно. [6]
Понятие энергии активации дает дополнительный источник для исследования механизмов реакций. [7]
Понятие энергии активации для таких сложных процессов, как пиролиз угля, не отражает химические превращения исходного вещества, но все же является полезным характеристическим показателем процесса. [8]
Понятие энергии активации, введенное еще Аррениусом и Вант-Гоффом, позволяет свести все многообразие молекул различных веществ к некоторой обобщенной энергетической характеристике. Как мы увидим в дальнейшем, предэкспоненциальный множитель ш0 также зависит от строения реагирующих молекул. [9]
Понятие энергии активации, введенное еще Аррениусом и Вант-Гоффом, позволяет нам свести все многообразие молекул различных веществ к некоторой обобщенной энергетической характеристике. Как мы увидим в дальнейшем, предэкспоненциальный множитель w0 также зависит от строения реагирующих молекул. [10]
Понятие энергии активации Е определяется существованием потенциальных барьеров, с преодолением которых связано любое химическое превращение. Параметр Е для реакций, протекающих в одну стадию, показывает, какой минимальной энергией ( в расчете на 1 моль) должны обладать реагирующие частицы, чтобы они могли вступить в химическую реакцию. Частицы, энергия которых больше или равна Е, называются активными, а параметр Е в связи с этим называется энергией активации. [11]
Поясним смысл понятия энергии активации. В химической кинетике для объяснения механизма химических реакций широкое распространение получила теория активных соударений, согласно которой для возникновения химического взаимодействия необходимо столкновение молекул, при этом принимается, что реагируют лишь только те молекулы, энергия которых не ниже некоторого предела Е, называемого энергией активации. Средняя энергия молекул, особенно при невысоких температурах, обычно ниже этого предела. Энергия активации является тем избыточным количеством энергии ( по сравнению со средней величиной энергии молекул), которой должна обладать молекула в момент столкновения, чтобы быть способной к химическому взаимодействию с другой молекулой. Такое активирование должно предшествовать ослаблению или разрушению внутренних связей реагирующих молекул, без чего невозможна перегруппировка атомов и образование новых молекул. [12]
Поясним смысл понятия энергии активации. В химической кинетике принимается, что для возникновения химического взаимодействия необходимо столкновение молекул, причем реагируют лишь только те молекулы, энергия которых не ниже некоторого предела Е, называемого энергией активации. [13]
Поясним смысл понятия энергии активации. В химической кинетике для объяснения механизма химических реакций широкое распространение получила теория активных соударений, согласно которой для возникновения химического взаимодействия необходимо столкновение молекул, при этом принимается, что реагируют лишь только те молекулы, энергия которых не ниже некоторого предела Е, называемого энергией активации. Средняя энергия молекул, особенно при невысоких температурах, обычно ниже этого предела. Энергия активации является тем избыточным количеством энергии ( по сравнению со средней величиной энергии молекул), которой должны обладать сталкивающиеся молекулы, чтобы быть способными к химическому взаимодействию. Такое активирование должно предшествовать ослаблению или разрушению внутренних связей реагирующих молекул, без чего невозможна перегруппировка атомов и образование новых молекул. [14]
 |
Энергия активации отдельных реакций. [15] |
Страницы: 1 2 3