Понятие - энергия - активация
Cтраница 2
Учитывая определение понятия энергии активации, можно сказать, что скорость химической реакции зависит от величины энергии активации и чем она больше, тем медленнее будет протекать реакция. [16]
Как видно, понятие энергии активации, как и константы скорости, подобно самому закону Аррениуса, строго говоря, относится к элементарным реакциям. [17]
Что подразумевается под понятием энергии активации электродного процесса. [18]
Уже отмечалось, что понятие энергии активации связано с представлением о некоторой избыточной энергии. Для осуществления любой реакции должен быть преодолен определенный энергетический барьер, разделяющий исходные вещества и продукты реакции. Рассмотрим подробнее, что происходит со сталкивающимися частицами. При сближении реагирующих молекул, вследствие взаимодействия их внешних электронных оболочек, между ними появляются силы отталкивания и, следовательно, происходит увеличение энергии. [19]
В § 62 будет введено понятие энергии активации для слияния ( синтеза) ядер в одно более крупное ядро. [20]
 |
Соотношение между теплотой реакции ( Q и энергией активации ( Еа. [21] |
Чтобы глубже проникнуть в сущность понятия энергии активации, необходимо рассмотреть вопрос о зависимости скорости химических реакций от температуры. [22]
 |
Диаграмма потенциальной энергии для реакции Н2 I2 2HI. [23] |
Чтобы познакомиться с тем, как применяется понятие энергии активации к конкретным химическим реакциям, рассмотрим реакцию между водородом и иодом с образованием иодида водорода. Эта реакция отнюдь не так проста, как это может показаться на первый взгляд, и на ее примере очень наглядно иллюстрируется та роль, которую играет энергия активации в химической реакции. В реакцию способны вступать только те молекулы, которые обладают достаточной энергией, чтобы преодолеть активационный барьер. Реакция между Н2 и 12 осуществляется через два активационных барьера. [24]
Это является следствием того факта, что использование понятия энергии активации и зависимостей, в которые она входит, оправдано лишь достаточно далеко от тем-яературы стеклования. [25]
 |
Зависимость константы. [26] |
Для характеристики склонности углеводородов и соединений к реакции используется понятие энергии активации, определяемой как избыточная энергия, которой обладают молекулы, вступающие в реакцию. Чем выше энергия активации, тем больше энергетический барьер, который нужно преодолеть для превращения обычных молекул в активные. В среднем энергия активации при термическом крекинге составляет 210 - 250 кДж / моль для реакций разложения и 125 кДж / моль для реакций уплотнения. [27]
В этой теории, как и в теории столкновений, пользуются понятиями энергии активации и активированного комплекса. Активированный комплекс рассматривается не как простая группировка атомов, а как истинный промежуточный продукт, существующий в течение очень короткого времени в реакции; его часто называют переходным состоянием. Кроме того, согласно этой теории, устанавливается истинное равновесие между реагентами и активированными комплексами. [28]
 |
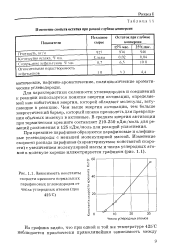
Коэффициенты стойкости резин. [29] |
Механизм термоокислительных реакций и механо-химических превращений сходен с механизмом цепных реакций, для описания которых применяют понятие энергии активации U процессов. В элементарных химических процессах энергией активации является избыточная энергия частицы ( например, молекулы), при которой она Находится в активном состоянии и способна вступить в химическую реакцию. [30]
Страницы: 1 2 3