Понятие - энергия - активация
Cтраница 3
К приобретают обобщенный характер, интегрально отражая множество происходящих процессов. Введение понятия энергии активации необходимо при описании явлений диффузии, вязкости, сорбции и других явлений, связанных с преодолением энергетического барьера. Это дает возможность использовать сходные математические модели для описания термоокислительных, механо-химических и диффузионных процессов старения. [31]
Физический смысл понятия энергии активации при механическом разрушении твердых тел будет подробно обсуждаться в гл. [32]
Данные таблицы свидетельствуют о достаточно высокой степени сходимости результатов расчета Е по данным изотермических и неизотермических измерений. Если мы вкладываем в понятие энергии активации, вычисленной по данным изотермических измерений, определенный физический смысл, то нет никаких оснований считать, что Е, рассчитанная по данным неизотермических измерений, лишена этого смысла. [33]
В связи с этим на первый взгляд может показаться странным, что экспериментальные исследования диффузии внедренных атомов в сплавах замещения приводят обычно к зависимостям In D от 1 / Т, не имеющим значительных отклонений от прямолинейности. С этим связан тот факт, что при таких экспериментальных исследованиях понятие энергии активации в ряде случаев применяется и к диффузии по междоузлиям сплавов замещения. Как будет показано ниже, такая ситуация объясняется тем, что в реальных сплавах отклонения от прямолинейности оказываются заметными лишь в весьма широком температурном интервале, не всегда реализуемом на опыте, или же при резких изменениях в протекании процесса диффузии, имеющих место, например, при температуре упорядочения сплавов. Нелинейные зависимости InD от 1 / Т были действительно обнаружены экспериментально в ряде сплавов рассматриваемого типа. [34]
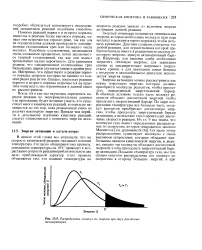 |
Распределение молекул по энергии при двух различных температурах. [35] |
После того как мы научились определять порядок реакции по экспериментальным данным о ее протекании, будет нелишне узнать, что существует много химических реакций, которые не начинаются до тех пор, пока реакционная смесь не получит некоторую энергию. Прежде чем перейти к детальному изучению кинетики реакций, следует ознакомиться с понятием энергии активации. [36]
Для перегруппировки, так же как и для простого разрыва связей, необходимо, чтобы на данной связи или группе связей сконцентрировалась энергия, достаточная для осуществления процесса. Трактовать эту энергию как энергию активации можно без оговорок только в случае статистических механизмов, так как само понятие энергии активации предполагает статистическое распределение молекул по величине тепловой энергии. [37]
Однако в оценке возможности протекания реакции синтеза большое значение имеет и ряд других условий. Понятие энергии активации как энергии, которую необходимо затратить для преодоления порога инертности, было введено еще Аррениусом [644] и должно обязательно учитываться при оценке возможности химической реакции в системе. [38]
Величина означает здесь энергию активации электропроводности, которая в полупроводниках, описываемых зонной моделью, обычно бывает связана с шириной запрещенной зоны ( собственная проводимость) либо с расстоянием донорного или акцепторного уровня от дна зоны проводимости или соответственно потолка вачентной зоны. В таком случае возрастание проводимости с температурой, как правило, связано с ростом числа носителей, в то время как подвижность меняется с температурой незначительно. Езли же зонное приближение неприменимо, то понятие энергии активации имеет более сложный смысл. Как мы увидим позднзз, температурная зависимость а в таком случае обычно обусловлена изменением подвижности. [39]
Френкелю [ 38J, если молекулы растворенного вещества достаточно велики, то они являются равноправными участниками ( наряду с молекулами растворителя) теплового движения. В этом случае теряется смысл величины энергии активации, поскольку молекулы растворенного вещества не участвуют в перескоках по дырочному механизму. Если размер молекул растворенного вещества сопоставим с размерами молекул растворителя, то понятие энергии активации приобретает смысл, но значение ее определяется величиной и характером межмолекулярных взаимодействий в среде. При этом оказывается, что значения энергий активации, отнесенные к молекулам растворителя и растворенного вещества, близки. [40]
Отметим, что со скоростью поступательного движения молекул связана только часть ее полной кинетической энергии. Температура оказывает влияние и на другие формы энергии движения молекул - на энергию молекулярных колебаний и энергию их вращения. Однако для простоты рассуждений можно пренебречь этими формами энергии, хотя не следует забывать, что они также влияют на скорость реакции, так как в понятие энергии активации входят все формы молекулярной энергии. [41]
Рассмотренная схема, конечно, существенно отличается от схемы образования частицы аэрозоля при конденсации. При образовании сажевой частицы лимитирующей стадией является не образование зародыша, а образование радикала-зародыша. Исключительно высокая энергия активации образования радикалов-зародышей характеризует трудность преодоления этой стадии процесса, которая и является лимитирующей стадией. В рассматриваемой схеме понятие энергии активации образования радикал-зародыша аналогично толкованию степени пересыщения при образовании частиц аэрозоля при конденсации. [42]
Попытки объяснить, исходя из энергии активации, этот малый температурный коэффициент для процесса, который определяет скорость реакции, приводят к неправдоподобно низким значениям энергии активации или к невероятно высоким значениям температуры поверхности. Однако из анализа природы процесса горения, описанного в предыдущих параграфах, очевидно, что такая простая интерпретация не может быть сделана. Реакция происходит не в изотермической области, а в области с очень большим градиентом температуры, где точное применение понятия энергии активации становится затруднительным. Скорость, при которой энергия сообщается твердому топливу, определяет скорость горения; температура в зоне реакции устанавливается так, чтобы поддерживался стационарный режим. [43]
Название стерический фактор не отражает физического смысла, так как этот множитель определяется не геометрической вероятностью, как предполагалось теорией соударений, а вероятностью благоприятной ориентации внутримолекулярных движений, которая приводит к замене части вращательных степеней свободы колебательными. Наблюдаемые в действительности низкие значения стерического фактора обусловлены затруднениями в передаче энергии от одной степени свободы молекулы к другой при образовании активированного комплекса. Таким образом, теория переходного состояния позволяет вычислить предэкспоненциальный множитель, если известна конфигурация реагирующих молекул в переходном состоянии. Но в большинстве случаев строение активного комплекса и его свойства бывают неизвестными, поэтому расчеты здесь затруднительны и ограничены. Теория переходного состояния позволяет также более строго определить понятие энергии активации. [44]
Страницы: 1 2 3