Потенциал - кадмий
Cтраница 2
Однако по той причине, что разность потенциалов кадмия и железа невелика ( сотые доли вольта), соотношение между потенциалами кадмия и железа в ряде случаев меняется и кадмий перестает электрохимически защищать железо. [16]
На кривой сплавов кадмия с медью ( рис. 162, Б) горизонтальный участок, начинающийся при 33 атомных % Си, указывает на существование соединения СсЬСи, потенциал которого на 0 26 в превышает потенциал кадмия. [17]
В ряду напряжений относительное расположение железа и кадмия не вполне определено, так как потенциалы их по данным разных исследователей различны. Однако по всем данным разность потенциалов кадмия и железа невелика и в зависимости от условий эксплуатации изделий в различных средах может-меняться в различных направлениях. Соотношение между потенциалами кадмия и железа меняется иногда таким образом, что кадмий электрохимически перестает защищать железо. [18]
Однако вследствие того, что в ряде напряжений потенциалы кадмия и железа разнятся между собой всего на несколько сотых вольта, то относительное значение потенциалов железа и кадмия может изменяться, а потому в некоторых случаях кадмий перестает быть электрохимическим защитником железа. [19]
Большим достоинством кадмиевых покрытий является их химическая стойкость в морской или соленой ноде, которая значительно выше стойкости цинка. Кроме того, рядом исследователей установлено, что потенциал кадмия в растворе хлористого натрия электроотрицательнее потенциала железа, в результате чего при образовании гальванопары кадмий - железо изделие в этих условиях будет подвергаться электрохимической защите. [20]
Если же нормальные потенциалы обоих металлов близки ( например для Fe - Fe2 - - 2 е норм, потенциал - 0 44 в, а для Cd - Cd2 2 е соответственно - 0 40 в), то одновременное растворение обоих металлов легко реализуется. А так как железо растворяется со значительным перенапряжением, вследствие чего его потенциал еще более приближается к потенциалу кадмия, то можно добиться одновременного растворения железного и кадмиевого анодов примерно в равных соотношениях. Это используют для получения железо-кадмиевой губки в производстве щелочных аккумуляторов. [21]
Стандартные потенциалы кадмия и железа различаются мало, поэтому характер защиты покрытия кадмием зависит от условий коррозионной среды. Так, во влажном тропическом и в приморском климате, а также в средах, содержащих хлориды, потенциал кадмия становится электроотрицательнее потенциала железа и кадмий защищает от коррозии черные и цветные металлы не только механически, но и электрохимически, причем надежнее, чем цинк, даже при меньшей толщине покрытия. [22]
Нормальные потенциалы кадмия и железа отличаются мало, поэтому характер защиты кадмия зависит от условий коррозионной среды. Так, во влажном тропическом и приморском климате, а также в средах, содержащих хлористые соли, потенциал кадмия становится электроотрицательнее потенциала железа и защищает его от коррозии не только механически, но и электрохимически. Действительно, в подобных условиях кадмий предохраняет от коррозии черные и цветные металлы надежнее, чем цинк, даже при меньшей толщине покрытия. [23]
Наиболее сильное влияние на структуру сплава оказывает состав электролита. Это находит свое объяснение при изучении поляризационных кривых [6], которые показывают, что при введении ализаринового масла потенциалы кадмия и серебра сближаются. [24]
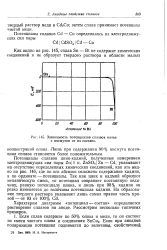 |
Зависимость потенциалов сплавов олова с висмутом от их состава. [25] |
Zn - Cd, указывают на отсутствие определенных химических соединений, как это видно на рис. 146, где по оси абсцисс отложено содержание кадмия, а по ординате - потенциалы. Так как цинк и кадмий образуют механическую смесь, то потенциал сохраняет постоянную величину, равную потенциалу цинка, и лишь при 90 % кадмия он резко изменяется до величины потенциала кадмия. [26]
Для пассивации кадмия требуется в несколько раз больше кислорода, чем для пассивации железа. В результате кадмиевый электрод лучше железного работает при низких температурах. Поскольку потенциал кадмия более положителен, чем потенциал водорода в щелочном растворе, Cd не может самопроизвольно растворяться в щелочи с выделением водорода. [27]
В ряду напряжений относительное расположение железа и кадмия не вполне определено, так как потенциалы их по данным разных исследователей различны. Однако по всем данным разность потенциалов кадмия и железа невелика и в зависимости от условий эксплуатации изделий в различных средах может-меняться в различных направлениях. Соотношение между потенциалами кадмия и железа меняется иногда таким образом, что кадмий электрохимически перестает защищать железо. [28]
Кадмирование применяется для защиты стальных изделий от коррозии. Защитные свойства кадмиевых покрытий во многом зависят от условий, в которых покрытия эксплуатируются. Это объясняется отчасти тем, что потенциалы кадмия и стали, довольно близкие по значению, могут претерпеть такие изменения, в результате которых характер защиты стали кадмием также изменится. Он может быть анодным, подобно защите цинком, или стать катодным, как у олова, меди и никеля. [29]
Кадмий имеет более близкий потенциал к железу, чем цинк. Характер защиты кадмием зависит от коррозионной среды. Во влажной атмосфере и в присутствии хлор-ионов потенциал кадмия становится электроотрицательнее потенциала железа и кадмий электрохимически защищает металл от коррозии. [30]
Страницы: 1 2 3