Потенциал - леннард-джонс
Cтраница 2
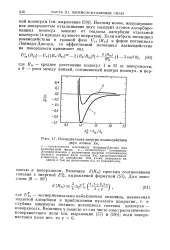 |
Потенциальная энергия взаимодействия двух атомов Хе. [16] |
Леннард-Дшонса для газообразной фазы; 2 - соответствует потенциалу Леннард-Джонса с включением энергии отталкивания третьего порядка двух атомов Хе, адсорбированных в монослое на вольфраме. Оба атома находятся на одном и том же расстоянии Rm от поверхности. [17]
Для неполярных и слабо полярных веществ d и в являются параметрами потенциала Леннард-Джонса. [18]
Его использование в практических расчетах однако затруднено необходимостью определения равновесного расстояния из потенциала Леннард-Джонса, требующего, согласно недавно развитом) 7 подходу [229], перехода к решеточной модели. Подобно предыдущим, эта зависимость содержи. Fm, методы измерения или расчета которого недостаточно однозначны и предполагают необходимость выбора соответствующего элемента макромолекулярной цепи. [19]
Эта формула получена для ГЦК-структуры в приближении взаимодействия только ближайших соседей, используя парный потенциал Леннард-Джонса. При этом атом колеблется с равными частотами по направлениям трех ортогональных осей координат. [20]
Вычисления были продолжены до п 100, используя концепцию плотной упаковки шаров ( обрезанный потенциал Леннард-Джонса [225]), но дополнительных максимумов, кроме максимума при п 55, обнаружено не было. Поэтому найденные предварительными вычислениями некоторые геометрически совершенные конфигурации для п 7, 33, 43, 45, 115 и 127 могут служить лишь в качестве пробных исходных структур при вычислениях на компьютере. Легко видеть, что многие из этих значений не совпадают с измеренными магическими числами. [21]
Методом молекулярной динамики исследовалось также суперпозиционное приближение и было показано, что для потенциала Леннард-Джонса оно нарушается при малых расстояниях. [22]
Чаще всего при расчетах второго вириального коэффициента для систем с центральными взаимодействиями пользуются потенциалом Леннард-Джонса. [23]
В данном параграфе на основе парного псевдопотенциала Хилла рассчитаны вторые и третьи вириальные коэффициенты для потенциалов Леннард-Джонса 12 - 6 и 12 - 4, моделирующих взаимодействие состояний непрерывного спектра нейтрал-нейтрал и заряд-нейтрал в плотных химически реагирующих газах и плазме. Для расчета третьего вириального коэффициента предложено соотношение между исходным и псевдопотенциалом, существенно упрощающим его расчет. [24]
При отсутствии экспериментальных данных о параметрах потенциала Штокмайера вязкость полярных веществ целесообразно оценивать с помощью потенциала Леннард-Джонса. [25]
Итак, характеристика молекул жидкостей, как шариков, взаимодействующих друг с другом с помощью потенциала Леннард-Джонса или другого эмпирического потенциала центральных сил, далека от действительности. Строение молекул и их индивидуальные особенности определяют строение жидкостей, в частности тех ассоциатов и комплексов, которые играют доминирующую роль в данной жидкой фазе. Строение молекул в конечном счете определяет и процессы, которые протекают в жидкостях, и механизмы этих процессов. [26]
На основе метода Монте-Карло и метода молекулярной динамики проведены расчеты различных термодинамических свойств системы частиц с потенциалом Леннард-Джонса. [27]
В общем смысле любая энергетическая характеристика поверхности складывается из полярной и неполярной компонент уже потому, что константа А потенциала Леннард-Джонса может быть представлена в виде суммы вкладов лондоновских, дебаевских и кеезомовских сил. Обычно степень полярности xf оценивают величиной дипольного момента. [28]
Следует иметь в виду, что значения d и е в потенциале Штокмайера не равны значениям этих величин в потенциале Леннард-Джонса. [29]
Следует отметить также тот факт, что взаимодействие атомов и молекул металлов даже в основном состоянии лишь приближенно может быть описано потенциалом Леннард-Джонса, поскольку они обладают большой поляризуемостью [103] и, строго говоря, не являются ван-дер-ваальсовыми. [30]
Страницы: 1 2 3 4