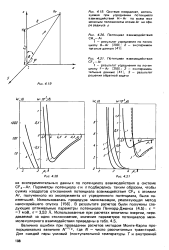
Потенциал - леннард-джонс
Cтраница 3
Перкуса - Йевика решено аналитически для непритягивающихся сфер; путем расчетов на ЭВМ также численные решения уравнения для систем, в которых взаимодействуют согласно потенциалу Леннард-Джонса. [31]
Как видно из табл. 11, для стержнеобразных молекул N2, О2, С2Н4, СаНе, Ы2О и СО2 потенциал Кихара дает более удовлетворительное совпадение между вычисленными и экспериментальными значениями РДИсс -, чем потенциалы Леннард-Джонса 12 - 6 и 28 - 7, В дальнейших работах [36, 38] Нагата и Кобаяси, пользуясь известными экспериментальными значениями Рдисс. Кихара с достаточной надежностью, а затем вычислили для азота константы Лэнгмюра применительно к гид-ратной структуре I. Следует отметить, что вычисления констант Лэнгмюра проводились на основании двух моделей молекулы: линейной и стержнеобразной. [32]
Использование при вычисления констант Лэнгмюра вместо потенциала Леннард-Джонса потенциала Кихара, который учитывает форму и размер молекул, позволяет для случая несимметричных молекул получать хорошую сходимость между расчетными и экспериментальными значениями РДИсс. Авторы раосматрисвали равновесие гидрат - газовая фаза вдоль кривой Р - Т в области температур от 0 до 33 С и давлений до 3000 атм. [33]
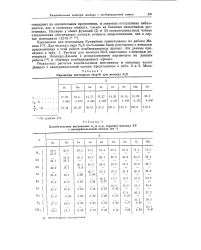 |
Параметры потенциала ( ехр-6 для молекул N2X. [34] |
Для молекул типа N2X постоянные были рассчитаны с помощью предложенных в этой работе комбинационных правил. Расчеты для молекул RnX выполнены с помощью потенциала Леннард-Джонса с использованием параметров по данным работы [13] и обычных комбинационных правил. [35]
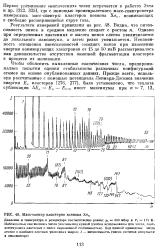 |
Масс-спектр кластеров ксенона Хеп. [36] |
Прежде всего, используя рассчитанные с помощью потенциала Леннард-Джонса значения энергии Еп кластеров [276, 277], было установлено, что теплота сублимации А. [37]
Вместе с тем различные расчеты приводят к весьма противоречивым результатам. Так, Бенсон и Шаттлворс [247], используя потенциал Леннард-Джонса, получили для кластеров Аг13 большие межатомные расстояния, чем в массивном кристалле. [38]
Параметры межмолекулярного взаимодействия позволяют в количественной форме охарактеризовать потенциальную функцию, описывающую энергию парного взаимодействия молекул. Эта функция, ( для неполярных веществ - потенциал Леннард-Джонса, для полярных - потенциал Штокмайера) широко используется в расчетах термодинамических и кинетических свойств веществ. [39]
В результате расчетов были получены следующие оптимальные параметры потенциала Леннард-Джонса (4.5): е 7 мэВ, а 3 53 А. [41]
С некоторой осторожностью следует пренебрегать тройными взаимодействиями, когда речь идет о сравнении энергий нескольких возможных кристаллических структур определенного вещества. Так, для всех кристаллов благородных газов, кроме Не, потенциалы Леннард-Джонса предсказывают гексагональную плотную упаковку при 0 К как самую выгодную энергетически, тогда как на самом деле благородные газы кристаллизуются в гранецентрированную решетку. [42]
Таким образом, вопрос о причинах расхождения рассчитанных и экспериментальных величин остается открытым. Не исключено, что эти расхождения связаны с неточностями в вычислениях потенциала Леннард-Джонса, дающего основной вклад в потенциальную энергию взаимодействия. Из табл. 2 мы видим, что между т) и температурой слета Гсл есть корреляция. Правда, у NaF и RbBr 14 заметно различаются, а Тсл - почти одинаковы, но, как полагает А. И. Губанов [70], это можно объяснить тем, что на NaF полиэтилен сжат, а на RbBr - растянут. [43]
В последние годы для описания взаимодействия между двух-и многоатомными молекулами широко пользуются атом-атомными потенциалами. Взаимодействия между валентно не связанными атомами описывают сферически симметричными потенциалами ( обычно это потенциалы Леннард-Джонса или ехр - 6), и потенциальную энергию системы представляют как сумму таких потенциалов. [44]
В работе [1] последней Фарадеевской дискуссии по структуре и свойствам жидкостей с помощью потенциала Леннард-Джонса и соответствующей вириальной функции расширенным методом Монте-Карло вычислены на ЭВМ термодинамические свойства жидкого аргона в широком интервале v и Т, оказавшиеся в хорошем согласии с экспериментальными величинами. [45]
Страницы: 1 2 3 4