Потенциал - начало
Cтраница 2
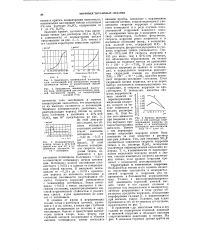
Потенциал - 0 25 в соответствует потенциалу начала пассивации. Потенциал полной пассивации соответствует 0 052 в и зависит от концентрации серной кислоты. Скорость коррозии уменьшается с повышением потенциала. Выше потенциала 0 052 в титан находится в пассивном состоянии, характеризующемся высокой коррозионной стойкостью в различных средах, к-рая практически не зависит от потенциала. [16]
Потенциал - 0 25 в соответствует потенциалу начала пассивации. Потенциал полной пассивации соответствует 0 052 в и зависит от концентрации серной кислоты. Скорость коррозии уменьшается с повышением потенциала. Выше потенциала 0 052 в титан находится в пассивном состоянии, характеризующемся высокой коррозионной стойкостью в различных средах, к-рая практически не зависит от потенциала. [18]
При потенциалах, более положительных, чем потенциал начала пассивации, скорость адсорбции кислорода уже превышает скорость обновления поверхности. Все большая часть поверхности титанового электрода покрывается хемосорбированным кислородом, вследствие чего сокращается активная поверхность металла и уменьшается плотность анодного тока. Епп, соответствующем минимуму плотности анодного тока, электрод полностью покрыт адсорбированным кислородом. Далее при потенциалах положительнее нуля в пассивной области анодное растворение титана идет с образованием четырехвалентных ионов титана, и для всех скоростей обновления поверхности наблюдается область независимости анодного тока от потенциала. [19]
Сопоставление величин потенциалов появления ионов азота и потенциалов начала реакции показывает, что реакция окисления азота начинается с образования ионов N, которые способны вступать во взаимодействие с молекулярным кислородом. [20]
Сопоставляя величины потенциалов появления ионов азота и потенциалов начала реакции, можно прийти к заключению, что реакция окисления азота начинается при образовании ионов Na, которые, по-видимому, способны вступать в непосредственное взаимодействие с молекулярным кислородом. [21]
Сопоставляя величины потенциалов появления ионов азота и потенциалов начала реакции, можно прийти к заключению, что реакция окисления азота начинается при образовании ионов Ng, которые, по-видимому, способны вступать в непосредственное взаимодействие с молекулярным кислородом. [22]
Первый из этих процессов начинается при достижении потенциала начала выделения кислорода фо, второй - потенциала анодирования ФАН. [23]
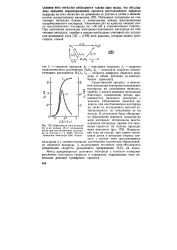 |
Зависимости тока на диске ( / и на кольце ( 2 от потенциала диска при восстановлении кислорода на платине в 1 н. КОН. Частота вращения электрода 3800 об / мин. [24] |
Потенциал полуволны на платиновых металлах близок к потенциалам начала восстановления адсорбированного кислорода. Увеличение рН на единицу смещает волну восстановления кислорода на - - 60 мВ в отрицательную сторону. [25]
Изменение режима старения влияет на коррозионный потенциал, потенциал начала пассивации, предельную плотность тока и плотность тока полной пассивации. Две последние величины возрастают при переходе структуры от состояния полного отжига к состоянию полного старения. В кислотных средах мартенситно-стареющие стали могут подвергаться и коррозионному растрескиванию. [26]
Кривая Ti в условиях щели показывает, что потенциал начала развития щелевой коррозии отрицательнее потенциала питтингообразования на 1 2 В. Таким образом, можно сказать, что результаты исследо-тания электрохимического поведения Ti при температуре 160 С указывают на вероятность коррозии и в щели, и в объеме раствора, однако инкубационный период начала коррозионного процесса в щели значительно меньше, чем в объеме. [27]
 |
Окислительно-восстановительные индикаторы. [28] |
Однако если ввести в титруемый раствор Н3РО4, то потенциал начала скачка резко понижается, и область перехода окраски дифениламина находится в пределах скачка потенциала на кривой титрования. [29]
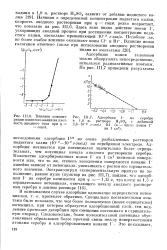 |
Йлияние концент - [ IMAGE ] 111 7. Адсорбция I на серебре. [30] |
Страницы: 1 2 3 4