Потенциал - никель
Cтраница 1
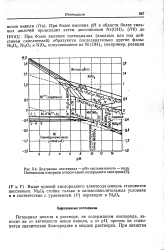 |
Диаграмма потенциал - рН системы никель - вода. Потенциалы измерены относительно водородного электрода. [1] |
Потенциал никеля в растворе, не содержащем кислорода, зависит не от активности ионов никеля, а от рН, причем он становится значительно благороднее в кислых растворах. [2]
Потенциалы никеля и кобальта в растворах простых солей незначительно отличаются друг от друга, поэтому вполне возможно совместное выделение на катоде никеля и. [3]
Потенциал никеля электроположительнее потенциала железа и, следовательно, никелевые покрытия защищают сталь от коррозии механически; электрохимической защиты они не создают. Сталь предохраняется от коррозии лишь сравнительно толстым никелевым покрытием, поэтому в практике широко развито никелирование с подслоем меди. Иногда осуществляют комбинированное покрытие: первый слой - никель, промежуточный слой - медь и последний слой - никель. [4]
Близость значений потенциалов никеля и водорода и в особенности низкое перенапряжение водорода на никеле мешают никелированию. [5]
Этот потенциал является истинным потенциалом никеля при данной концентрации электролита и температуре. [6]
Стандартный потенциал кобальта близок к потенциалу никеля и всего на 27 мВ отрицательнее его. Так же как никель, кобальт сильно корродирует в растворах кислот и солей, обладающих окислительными свойствами, например HNO3 и FeCls. Он стоек в горячих и холодных щелочах, но в меньшей степени, чем никель. [7]
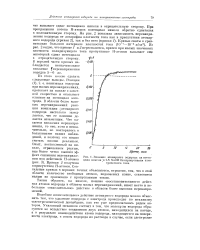 |
Влияние атомарного водорода на потенциал никеля. в 1N NaOH без пропускания электрического тока. [8] |
При прекращении потока Н - атомов потенциал никеля обратно сдвигался в положительную сторону. Из рис. 2 видно, что кривые 1 и 2 пересекаются, причем при малых значениях плотности поляризующего тока пропускание Н - атомов вызывает еще некоторый сдвиг потенциала в отрицательную сторону. [9]
 |
Зависимость потенциалов никелевого ( / и /, кобальтового ( 2 и 2, железного ( 3 и 3 электродов от температуры в 1н сернокислых растворах, рН1 5. [10] |
На рис. 2 представлена экспериментально полученная зависимость потенциалов никеля [3], кобальта [13] и железа ( кривые 1, 2 и 3 соответственно) от температуры. [11]
На рис. 1 показано влияние атомарного водорода на потенциал никеля в 1 TV NaOH без пропускания электрического тока. По оси абсцисс отложено время в минутах; по оси ординат - потенциал электрода в вольтах против обратимого водородного электрода. Как видно из хода кривой ( рис. 1), в начале опыта потенциал электрода был на 550 мв по-ложительнее водородного. Под действием Н - атомов потенциал никеля постепенно сдвигался в отрицательную сторону и через 20 мин. [12]
Ар 2 - - 0 27 в) близок к потенциалу никеля. [13]
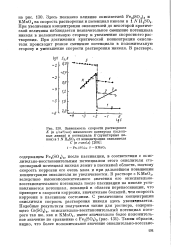 |
Зависимость скорости растворения К ( в г / см2 / час никелевого электрода ( сплошные линии и потенциала Е ( пунктирные линии в 1 N H2SO4 от концентрации окислителя С ( в г-вкв / л. [14] |
При увеличении концентрации окислителей до некоторой критической величины наблюдается незначительное смещение потенциала никеля в положительную сторону и увеличение скорости его растворения. При достижении критической концентрации окислителя происходит резкое смещение потенциала в положительную сторону и уменьшение скорости растворения никеля. [15]
Страницы: 1 2 3