Потенциал - полуэлемент
Cтраница 1
Потенциалы полуэлемента были получены непосредственно из измеренных критических потенциалов, осаждения; поправки применялись лишь для перехода от каломелевого к водородному алектроду и в некоторых случаях для перехода от восстановительных потенциалов к окислительным. [1]
Потенциал полуэлемента определяется по отношению к нормальному водородному электроду. Нормальным водородным электродом является электрод, состоящий из платины, насыщенной газообразным водородом под давлением в одну атмосферу и опущенной в раствор ионов водорода с активностью, равной единице. Потенциал такого электрода принят равным нулю. [2]
Потенциал полуэлемента определяется по отношению к нормальному водородному электроду. Нормальным водородным электродом является электрод, состоящий из платины, насыщенной газообразным водородом под давлением в одну атмосферу и опущенный в раствор, содержащий ионы водорода с активностью, равной единице. Потенциал такого электрода принят равным нулю. [3]
Потенциал полуэлемента зависит от потенциала двойного электрического слоя, но экспериментальных методов для его определения не существует. Поэтому находят не абсолютную ср, а относительную величину электродного потенциала, выбирая какой-либо другой полуэлемент для сравнения. Испытываемый полуэлемент соединяют с водородным полуэлементом металлической проволокой и определяют ЭДС полученного химического источника тока. [4]
 |
Потенциомет-рическая схема. [5] |
Потенциал полуэлемента для любого электрода, выраженный таким образом, отсчитывают по нормальной или стандартной водородной шкале и иногда обозначают в виде еи. [6]
Потенциал полуэлемента определяется по отношению к нормальному водородному электроду. Нормальным водородным электродом является электрод, состоящий из платины, насыщенной газообразным водородом под давлением в одну атмосферу и опущенной в раствор, содержащий ионы водорода с активностью, равной единице. Потенциал такого электрода принят равным нулю. [7]
Потенциал полуэлемента H / GE при постоянной ионной силе определяется уравнением ( 7 - 8), где Е0 зависит от рН внутреннего раствора, потенциала полуэлемента сравнения, потенциала асимметрии мембраны, который незначительно меняется со временем. Область концентраций водородных ионов, в которой уравнение ( 7 - 8) сохраняет силу для данного электрода, зависит от типа стекла и его гидратации. Отклонения чаще всего встречаются в сильнокислых и в щелочных растворах. В последнем случае так называемая щелочная ошибка особенно заметна при высоких концентрациях катионов металлов главной под-групы 1 - й и 2 - й групп, но при применении литиевого стекла она может быть значительно уменьшена. Область рН, в которой уравнение ( 7 - 8) справедливо для электродов, выпускаемых промышленностью, указывается в описании, но ее следует проверить экспериментально через частые интервалы ( стр. [8]
Для потенциала полуэлемента принимают тот знак, который он имеет в паре с водородным электродом, если водородный электрод записан слева в цепи. В цепи Pt ( Н2) Н Си2 1) Си при а а 2 положительный полюс находится на меди. Это значит, что электрод Си) Си имеет положительный заряд. [9]
Для потенциала полуэлемента принимают тот знак, который он имеет в паре с водородным электродом, если водородный электрод записан слева в цепи. [10]
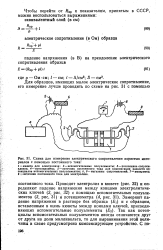 |
Схема для измерения электрического сопротивления пористых материалов с помощью постоянного тока. [11] |
Так как потенциалы вспомогательных полуэлементов иногда отличаются друг от друга на доли милливольта, то для выравнивания этой величины в схеме предусмотрено компенсирующее устройство. [12]
Он значительно меньше потенциалов полуэлементов. При измерении ЭДС цепи потенциал фдифф стараются уменьшить. [13]
Выше потенциала водорода даны потенциалы полуэлементов, которые по отношению к водороду являются окислителями. В гальванический цепи с стандартным водородным электродом такие полуэлементы принимают электроны от водорода; значения кх потенциалов в полученном элгменте имеют положительный знак. В этих полуэлементах протекают реакции восстановления. [14]
Выше потенциала водорода расположены потенциалы полуэлементов, которые по отношению к водороду являются окислителями. В гальванической цепи со стандартным водородным электродом такие полуэлементы принимают электроны от водорода; значения их потенциалов имеют положительный знак. В этих полуэлементах протекают реакции восстановления. [15]
Страницы: 1 2 3 4